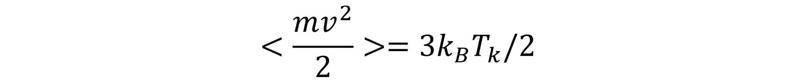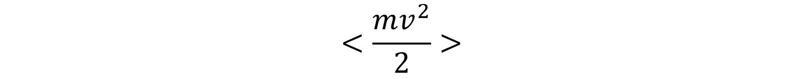Termodinamika balstās uz vairākiem postulātiem un trīs termodinamikas likumiem. Saskaņā ar pirmo postulātu izolētas sistēmas (sistēmas, kuras neapmainās ar enerģiju un masu ar apkārtējām) pēc noteikta laika, ko sauc par termiskās relaksācijas laiku, nonāk termodinamiskā līdzsvara stāvoklī, kurš turpmākā laika gaitā nemainās. Otrais postulāts, ko bieži min arī kā nulles termodinamikas likumu, runā par termodinamiskā līdzsvara transitivitāti, t. i., ja ķermenis A ir līdzsvarā ar ķermeni B, bet ķermenis B ir līdzsvarā ar ķermeni C, tad ķermenis A ir līdzsvarā ar ķermeni C. No šī postulāta izriet, ka eksistē fizikāls lielums – temperatūra, kura termodinamiskā līdzsvarā esošiem ķermeņiem ir vienāda. Temperatūra var tikt mērīta ar ķermeņa, kurš kalpo par termometru, stāvokļa izmaiņām. Tas var būt, piemēram, dzīvsudraba termometrs. No nulles termodinamikas likuma formulējuma redzams, ka ķermenis B kalpo kā termometrs, jo tas termodinamiskā līdzsvarā esošiem ķermeņiem A un C uzrāda vienu un to pašu temperatūru.
Raksturojot termodinamiskas sistēmas, izmanto iekšējo un ārējo parametru jēdzienus. Ārējie parametri ir atkarīgi no ārpus sistēmas esošiem ķermeņiem, piemēram, trauka tilpums, kurā atrodas gāze. Iekšējie parametri no ārpus sistēmas esošiem ķermeņiem nav atkarīgi, piemēram, gāzes spiediens. No nulles termodinamikas likuma izriet, ka termodinamiskā līdzsvara stāvoklis ir viennozīmīgi noteikts ar sistēmas enerģiju un ārējiem parametriem, vienkāršākajā gadījumā – tilpumu. Tas nozīmē, ka temperatūra – lielums, kurš raksturo termodinamiskā līdzsvara stāvokli, – ir atkarīga no sistēmas enerģijas un tilpuma, jeb, citiem vārdiem runājot, temperatūra ir sistēmas enerģijas un tilpuma funkcija. Redzams, ka sistēmas enerģija var tikt uzdota kā sistēmas temperatūras un tilpuma funkcija. Šo funkciju raksturo kā kalorisko vienādojumu. Līdzīgi arī citi iekšējie parametri (piemēram, spiediens) ir temperatūras un ārējo parametru (piemēram, tilpuma) funkcijas. Šīs atkarības sauc par stāvokļa vienādojumiem. Tie var tikt iegūti eksperimentāli (piemēram, pazīstamie Boila–Mariota, Gē-Lisaka un Šarla likumi gāzēm) vai arī izmantojot statistiskās fizikas metodes.