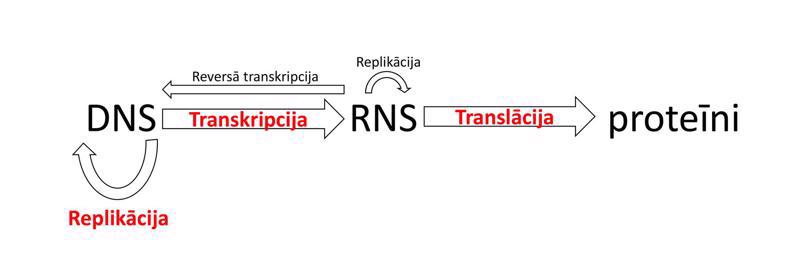
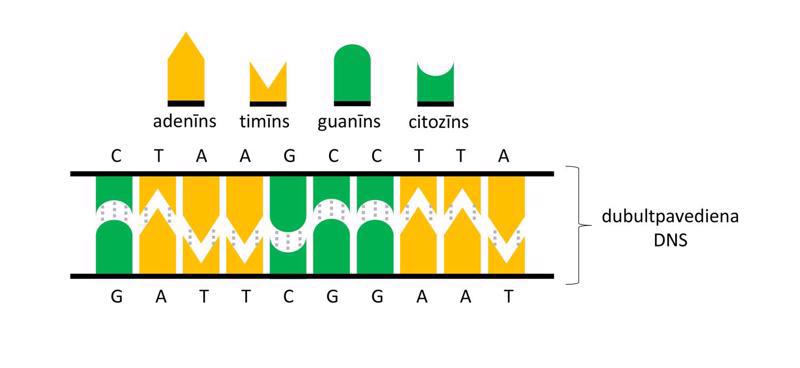
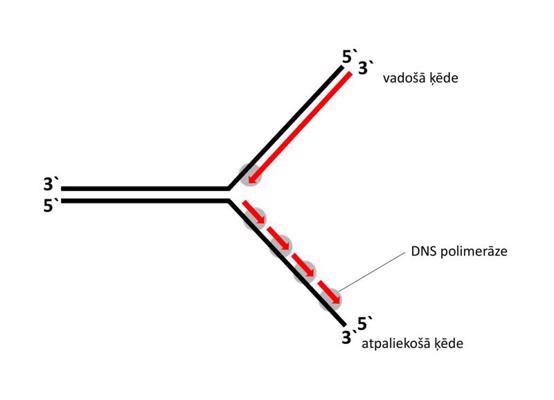
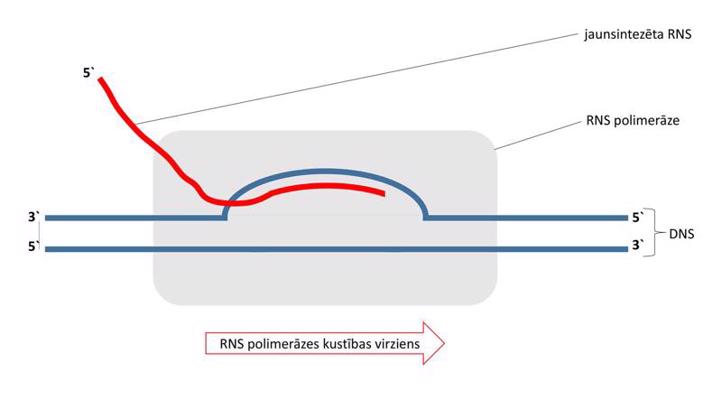
Makromolekulu (DNS, RNS un proteīnu) atpazīšanai, sekvences noteikšanai, pavairošanai, mijiedarbības pētīšanai un aktivitātes noteikšanai pielieto vispārīgās molekulārās bioloģijas metodes – molekulāro klonēšanu, elektroforēzi, polimerāzes ķēdes reakciju, blotēšanu un sekvencēšanu. Viena no plašāk izmantotajām metodēm ir molekulārā klonēšana (molecular cloning), kurā tiek izveidota rekombinanta DNS. Par rekombinantu DNS sauc jebkuru dabā neatrodamu hibrīdu DNS, kas tiek izveidota savienojot dažādas DNS laboratorijas apstākļos. Interesējošais DNS fragments tiek ievietots vektorā, kas parasti ir plazmīda – neliela, cirkulāra DNS molekula, kas dabiski atrodama baktērijās. Šādu rekombinantu DNS var tālāk sekvencēt, pavairot un ekspresēt. Rekombinantās DNS izmantošana proteīnu producēšanā sniedz vairākas priekšrocības – lielākus iznākumus, plašākas iespējas efektīvāk attīrīt proteīnu un modificēt proteīna sekvenci. Elektroforēze balstās uz to, ka makromolekulas migrācijas ātrums elektriskajā laukā cauri gēlam ir apgriezti proporcionāls tās izmēriem. Līdz ar to makromolekulas gēlā sadalās atbilstoši izmēriem – mazākās migrē ātrāk, lielākās lēnāk. Makromolekulu veidotās zonas vizualizē, salīdzina ar standartiem un izdara secinājumus par parauga sastāvu un tīrību. Polimerāzes ķēdes reakcija (polymerase chain reaction, PCR) ir metode, ar kuras palīdzību pavairo DNS molekulu tūkstošiem līdz miljoniem reižu. Metodes pamatā ir termālā ciklēšana, ar kuras palīdzību DNS dubultspirāle tiek denaturēta (abi dubultspirāles pavedieni tiek atdalīti viens no otra) augstākā temperatūrā un pavairota zemākā temperatūrā. Metode ir ļoti jutīga, un to var izmantot diagnostiskos nolūkos, piemēram, nosakot cilvēka imūndeficīta vīrusa (human immunodeficiency virus, HIV) daudzumu asinīs. Blotēšana (blot) pamatojas uz specifisku makromolekulu mijiedarbības detektēšanu, izmantojot ar radioaktīviem izotopiem, fluorescenti vai enzimātiski iezīmētas zondes mijiedarbību ar analizējamo paraugu. Ja izmanto DNS zondi, metodi sauc par Sauzerna blotēšanu (Southern blot). Ja kā zondi izmanto RNS, metodi sauc par norzerna blotēšanu (northern blot). Ja kā zondi izmanto antivielas, metodi sauc par vesterna blotēšanu (western blot). Precīzas DNS sekvences noskaidrošanai izmanto Sangera sekvencēšanu (Sanger sequencing) (metode izveidota 1975. gadā), bet ātrākas, jaudīgākas un lētākas ir pirosekvencēšana (pyrosequencing), Ion Torrent sekvencēšana (Ion Torrent sequencing), Illumina sekvencēšana (Illumina sequencing), SOLiD sekvencēšana (SOLiD sequencing) un nanoporu sekvencēšana (nanopore sequencing). Ar modernām sekvencēšanas metodēm iespējams noteikt cilvēka genoma sekvenci dažu dienu laikā.