Bioķīmijai radniecīga nozare ir molekulārā bioloģija, kas pēta procesus, kuri gēnos iekodēto informāciju izmanto organisma funkciju nodrošināšanai. Robeža starp bioķīmiju un molekulāro bioloģiju nav stingri definēta, dažkārt molekulāro bioloģiju uzskata par bioķīmijas apakšnozari. Pirmo reizi vārdu “bioķīmija” 1877. gadā lietoja vācu zinātnieks Fēlikss Hoppe-Zeilers (Felix Hoppe-Seyler) kā sinonīmu fizioloģiskajai ķīmijai.
bioķīmija
Saistītie šķirkļi

Daudznacionālā biofarmācijas uzņēmuma “Amgen” laboratorijā pētniece strādā ar hromatogrāfijas kolonnu, kas attīra proteīnus. Tauzendouksa, Kalifornijas pavalsts, ASV. 25.04.2013.
Ķīmiskie procesi atbildīgi par praktiski visām dzīvības izpausmes formām, tādēļ bioķīmiskie pētījumi ir pamatā visām dzīvības zinātnēm – īpaši bioloģijai un medicīnai. Bioķīmisko procesu zināšanas tiek izmantotas jaunu medicīnisku preparātu radīšanā. Bioķīmiskajiem pētījumiem ir nozīme biotehnoloģiju attīstībā. Bioķīmijas pētījumi un metodes tiek pielietotas arī augu un dzīvnieku šķirņu selekcijā, lauksaimniecībā, kriminālistikā un citur.
Bioķīmija ir starpdisciplināra zinātne, kas apvieno ķīmiju un bioloģiju.
Dzīvnieku bioķīmija pēta ķīmiskos procesus dzīvnieku organismos. Augu bioķīmija pēta ķīmiskos procesus augos. Mikrobu bioķīmija pēta ķīmiskos procesus mikroorganismos. Strukturālā bioķīmija pēta bioloģisko makromolekulu trīsdimensionālo uzbūvi. Metaboliskā bioķīmija pēta organismu metaboliskos ceļus. Molekulārā bioloģija pēta procesus, kuri gēnos iekodēto informāciju izmanto organisma funkciju nodrošināšanai – īpaši replikāciju, transkripciju un translāciju. Enzimoloģija pēta enzīmu aktivitāti, uzbūvi, substrātus un inhibitorus.
No 92 dabā sastopamajiem ķīmiskajiem elementim tikai 25 elementi nepieciešami dzīvo organismu veidošanai. Četri pamatelementi – ogleklis C, ūdeņradis H, skābeklis O un slāpeklis N – veido aptuveni 96 % no dzīvas šūnas masas. Gandrīz visus atlikušos 4 % veido makroelementi: kalcijs Ca, fosfors P, sērs S, magnijs Mg, kālijs K, nātrijs Na un hlors Cl. Mikroelementi dzīvajiem organismiem nepieciešami ļoti nelielos daudzumos – katrs mazāk par 0,01 %. Nozīmīgākie mikroelementi ir dzelzs Fe, cinks Zn, varš Cu, mangāns Mn, molibdēns Mo, kobalts Co un selēns Se.
Lielāko daļu no dzīvas šūnas sausā atlikuma masas sastāda bioloģiskās makromolekulas. Izšķir četras bioloģisko makromolekulu pamatklases: proteīnus, ogļhidrātus, lipīdus un nukleīnskābes.
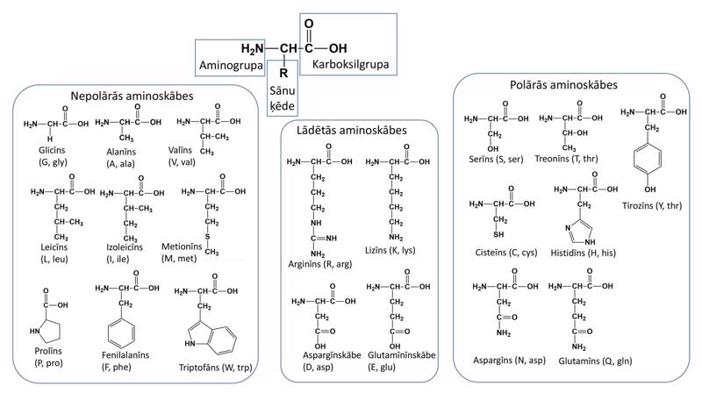
Proteīni ir biopolimēri, kuri sastāv no kovalenti savienotām aminoskābēm. Vispārīgā gadījumā aminoskābes ir ķīmiski savienojumi, kuru sastāvā ir aminogrupa (-NH2) un karboksilgrupa (-COOH). Proteīnu sastāvā ietilpst 20 dažādas proteinogēnās aminoskābes. Visas proteinogēnās aminoskābes ir α-aminoskābes, t. i., aminogrupa un karboksilgrupa ir pievienotas pie viena un tā paša oglekļa atoma. Pie tā paša oglekļa atoma pievienots arī ūdeņraža atoms un t. s. sānu ķēde, kura katrai no 20 proteinogēnajām aminoskābēm ir atšķirīga (1. attēls).
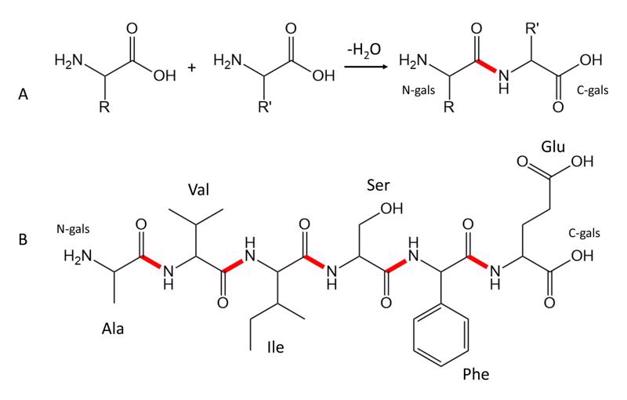
Sānu ķēde var saturēt dažādas funkcionālās grupas, kuras nosaka aminoskābes īpašības. Aminoskābes var viena ar otru kovalenti savienoties, savstarpēji reaģējot to aminogrupām un karboksilgrupām. Reakcijas rezultātā veidojas peptīda saite, kas ķīmiski identiska amīda saitei. Savienojoties vairākām aminoskābēm, veidojas polipeptīda ķēde (2. attēls).
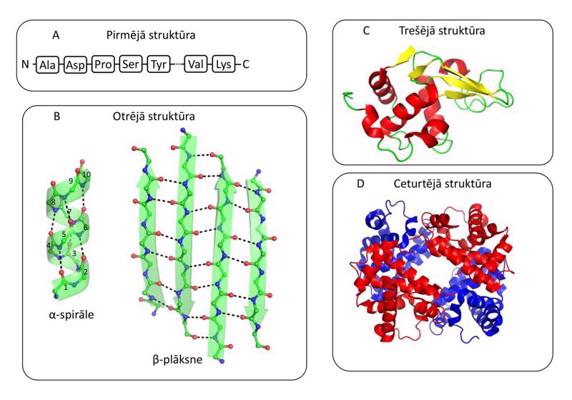
Par peptīdu sauc savienojumu, kurš sastāv no nedaudzām (aptuveni 2–100) aminoskābēm. Proteīniem parasti ir garākas polipeptīdu ķēdes, kuras sastāv no 100 līdz pat vairākiem tūkstošiem aminoskābju. Proteīniem izšķir vairākus strukturālās organizācijas līmeņus (3. attēls).
Proteīna pirmējā struktūra ir lineāra aminoskābju sekvence polipeptīda ķēdē. Polipeptīda ķēdes sastāvā esošās amīda grupas un karbonilgrupas savstarpēji var veidot ūdeņraža saites, rezultātā veidojot otrējās struktūras elementus. Polipeptīdu ķēdes rajons var izveidot spirālveida vai izstieptas struktūras, kuras sauc attiecīgi par α-spirālēm un β-virknēm. Otrējās struktūras elementiem vienam ar otru mijiedarbojoties, izveidojas proteīna trešējā struktūra, t. i., attiecīgās polipeptīda ķēdes trīsdimensionālā struktūra. Visbeidzot vairākas vienādas vai atšķirīgas polipeptīdu ķēdes ar izveidotu trešējo struktūru var savstarpēji apvienoties, veidojot proteīnu ceturtējo struktūru. Daudzi proteīni sastāv no vienas polipeptīda ķēdes, un tiem ceturtējā struktūra neveidojas. Funkcionāli proteīni ir ļoti daudzveidīgi biopolimēri. Strukturālie proteīni pilda noteiktas mehāniskas funkcijas organismā vai šūnā. Piemēram, kolagēns nodrošina dažādu saistaudu – skrimšļu, kaulu un ādas – strukturālās īpašības. Transportproteīni transportē dažādas vielas organismā – piemēram, hemoglobīns transportē skābekli. Receptori iesaistīti atbildēs uz dažādiem signāliem. Iespējams, visnozīmīgākie proteīni ir enzīmi, kuri katalizē gandrīz visas organismā notiekošās ķīmiskās reakcijas.
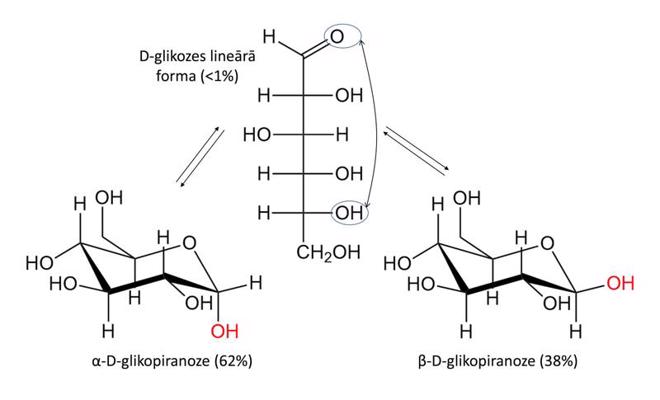
Ogļhidrāti ir organiski savienojumi, kuru monomēru sastāvā ietilpst hidroksil- (-OH) un karbonil- (C=O) funkcionālās grupas. Vienkāršākie ogļhidrāti ir monosaharīdi. Vienkāršāko monosaharīdu vispārējā formula ir Cn(H2O)n, kur n=3...7. Tipiski monosaharīdi satāv no oglekļa atomu virknes, kur viens no oglekļiem ir karbonilgrupas sastāvā, bet pie katra no pārējiem oglekļiem ir piesaistīta viena hidroksilgrupa (4. attēls).
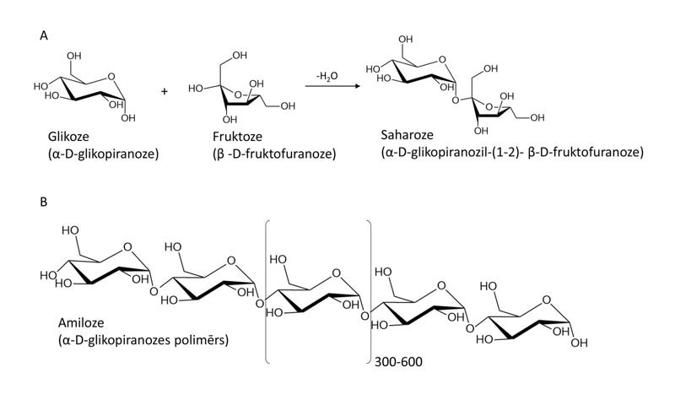
Papildus monosaharīdi var saturēt arī citas funkcionālās grupas. Monosaharīdi var pastāvēt kā lineāras virknes, bet bieži viena no hidroksilgrupām reaģē ar tajā pašā molekulā esošo karbonilgrupu, veidojot dažādus cikliskus izomērus (4. attēls). Divu vai vairāku monosaharīdu hidroksilgrupas var savstarpēji reaģēt, veidojot di-, tri-, oligo- vai poli- saharīdus (5. attēls).
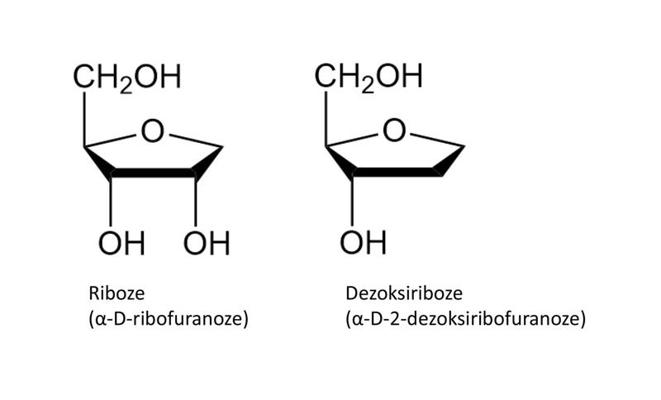
Ja polimēra virknē ir mazāk par 20 monosaharīdu vienībām, savienojumu sauc par oligosaharīdu, ja vairāk par 20 – par polisaharīdu. Ogļhidrāti kalpo kā enerģijas avoti, arī kā izejmateriāli citu savienojumu biosintēzei. Glikoze ir dabā visizplatītākais monosaharīds, kuru enerģijas ieguvei un biosintēzei izmanto lielākā daļa dzīvo organismu. Ciete un glikogēns ir polimēri, kuri sastāv no glikozes monomēriem un tiek izmantoti kā organisma barības vielu rezerve. Celuloze arī ir glikozes polimērs, kurš veic galvenokārt strukturālas funkcijas. Nozīmīgi monosaharīdi ir riboze un dezoksiriboze (6. attēls), kuras ietilpst nukleīnskābju sastāvā.
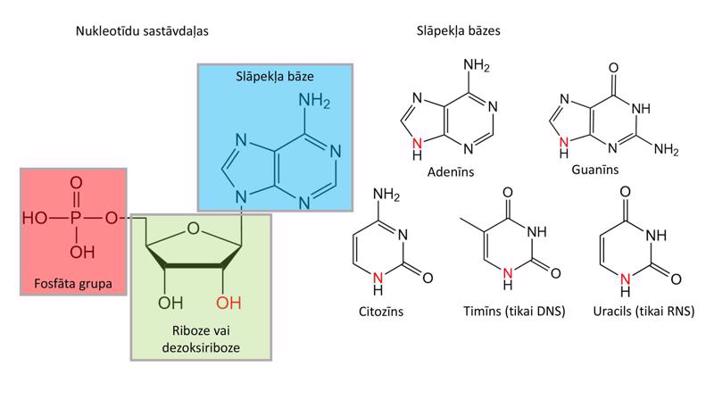
Nukleīnkābes ir biopolimēri, kuri kodē organisma ģenētisko informāciju un nodrošina ģenētiskā koda pārnesi uz proteīniem. Nukleīnskābju monomērus sauc par nukleotīdiem. Katrs nukleotīds sastāv no ribozes vai dezoksiribozes monosaharīda, kuram pievienota fosfāta grupa un slāpekļa bāze (7. attēls).
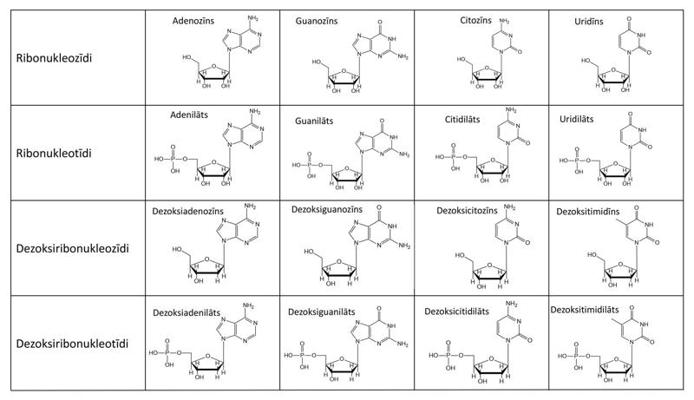
Nukleotīdus bez fosfāta grupas sauc par nukleozīdiem. Slāpekļa bāzes ir heterocikliski, aromātiski savienojumi. Dezoksiribonukleīnskābju (DNS) nukleozīdi sastāv no dezoksiribozes un timīna, citozīna, adenīna un guanīna slāpekļa bāzēm, bet ribonukleīnskābju (RNS) nukleozīdi – no ribozes un uracila, citozīna, adenīna un guanīna slāpekļa bāzēm. Tādējādi gan DNS, gan RNS sastāvā ir četras atšķirīgas slāpekļa bāzes. Attiecīgos nukleozīdus sauc par adenozīnu (A), guanozīnu (G), citidīnu (C), timidīnu (T) un uridīnu (U), bet attiecīgos nukleotīdus – par adenilātu, guanilātu, citidilātu, timidilātu un uridilātu (8. attēls).
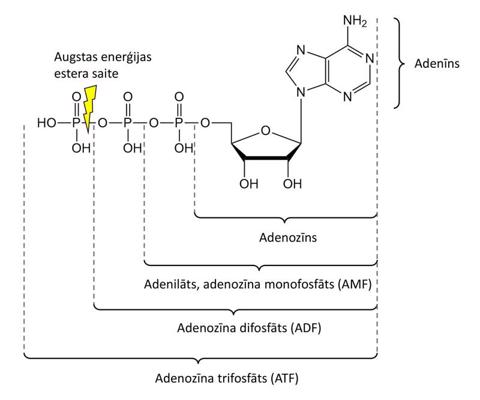
Nukleotīdu un nukleozīdu DNS formām bieži pievieno priedēkli dezoksi-, piemēram, dezoksiadenozīns (dA). Nukleīnskābju sastāvā katram nukleotīdam ir tikai viena fosfāta grupa, bet brīviem nukleotīdiem var būt viena, divas vai trīs virknē savienotas fosfāta grupas. Savienojumu nosaukumus darina no attiecīgo nukleozīdu nosaukuma, minot fosfāta grupu skaitu, piemēram, adenozīna trifosfāts (ATF, 9. attēls) vai dezoksiguanozīna difosfāts (dGDF).
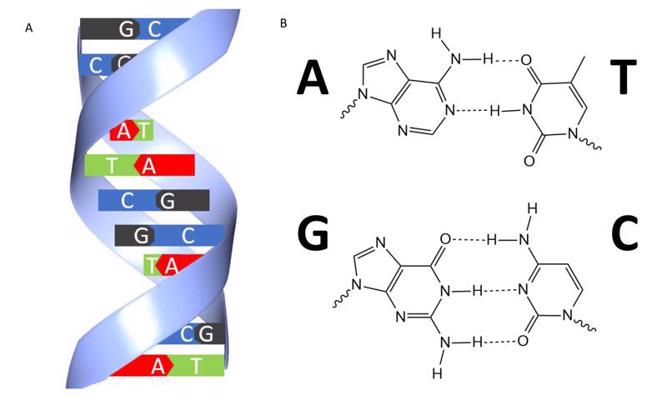
Svarīga slāpekļa bāzu īpašība ir to spēja veidot savstarpējas specifiskas ūdeņraža saites. DNS dubultspirāle satāv no diviem komplementāriem DNS pavedieniem. Katra pavediena slāpekļa bāzes veido ūdeņraža saites ar otra pavediena slāpekļa bāzēm, turklāt adenīns vienmēr veido ūdeņraža saites ar timīnu un citozīns – ar guanīnu (10. attēls).
Bāzu pāru komplimentaritātes princips nodrošina ģenētiskās informācijas nodošanu nākamajām paaudzēm. Nukleotīdiem, it sevišķi ATF, ir būtiska nozīme šūnas bioenerģētikā. No ATF atšķeļoties vienai fosfāta grupai, veidojas adenozīna difosfāts (ADF) un atbrīvojas ievērojams enerģijas daudzums (9. attēls). Iegūto enerģiju enzīmi izmanto dažādu enderogēnu reakciju veikšanai.
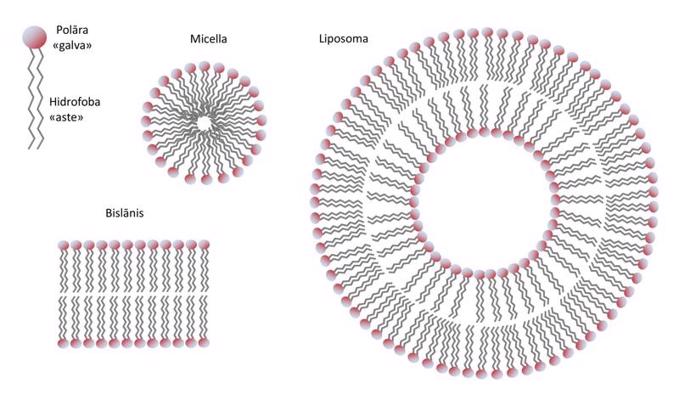
Lipīdi ir mazmolekulāri, hidrofobi, ūdenī nešķīstoši savienojumi, kuri pieder pie dažādām ķīmisko savienojumu klasēm. Bieži lipīdus uzskata par sinonīmiem taukiem, bet tauki (taukskābju un glicerīna esteri) ir tikai viens no lipīdu veidiem. Lipīdi neveido kovalenti saistītu polimēru struktūras, tāpēc tie nav klasiskas makromolekulas. Tomēr daži lipīdi var veidot milzīgus, nekovalenti saistītus kompleksus, piemēram, šūnu membrānas. Funkcionāli lipīdus iedala vairākās klasēs. Enerģijas uzkrājēji – taukskābju un glicerīna esteri – kalpo kā barības vielu rezerves. Vaski – taukskābju un garķēžu spirtu esteri – veic mehāniskas un aizsardzības funkcijas. Dzīvības procesiem nozīmīgākie ir šūnu membrānas veidojošie fosfolipīdi, glikolipīdi, sfingolipīdi un steroli. Membrānu lipīdu molekulām ir hidrofoba “aste” un polāra “galva”. Hidrofobajām “astes” daļām ir tendence mijiedarboties vienai ar otru, bet polārā “galva” mijiedarbojas ar ūdens vidi, tādējādi veidojot micellas, bislāņus un liposomas (11. attēls). Citi lipīdu veidi darbojas kā signālmolekulas, hormoni, pigmenti un enzīmu kofaktori.
Ķīmisko reakciju kopumu organismā sauc par metabolismu. Metabolismā izšķir divus pretējus procesus: anabolismu un katabolismu. Anabolisms ir visu organismam nepieciešamo vielu sintēze. Katabolisms ir barības vielu un citu organismā esošo vielu noārdīšana, lai iegūtu materiālu un enerģiju anabolismam. Katabolismā organismā esošie biopolimēri vispirms tiek noārdīti līdz monomēriem, bet monomēri – līdz vēl sīkākām vienībām. Piemēram, ciete vispirms tiek noārdīta līdz glikozei, bet glikoze tālāk tiek oksidēta līdz acetilgrupām un visbeidzot līdz ogļskābajai gāzei un ūdenim. Organisko vielu sintēzei ir nepieciešams enerģijas avots. Enerģijas avots var būt saules enerģija (fototrofiem organismiem) vai ķīmiskie savienojumi (hemotrofiem organismiem). Lielākā daļa augu ir fototrofi organismi, bet visi dzīvnieki, ieskaitot cilvēku – hemotrofi. Lai iegūtu enerģiju, dzīvnieku organisms oksidē barības vielās esošos organiskos savienojumus un iegūto enerģiju vispirms pārvērš universāli izmantojamā formā – parasti adenozīntrifosfātā (ATF). Iegūtā enerģija var tikt izmantota organismam nepieciešamo savienojumu sintēzei vai arī enerģijas rezervju veidošanai tauku un ogļhidrātu formā.
Enzīmi ir katalītiskas biomolekulas, kuras paātrina metabolisma procesus. Cilvēka organisms satur aptuveni 75 000 dažādu enzīmu, no kuriem katrs spēj katalizēt noteiktu ķīmisko reakciju. Gandrīz visi enzīmi ir proteīni, bet katalītiskas īpašības piemīt arī dažām RNS molekulām – piemēram, ribosomu sastāvā esošā RNS katalizē peptīda saites veidošanos. Enzīmi ir ļoti efektīvi katalizatori – piemēram, enzīms orotidīna fosfāta dekarboksilāze reakciju paātrina 1017 reizes – tātad reakcija, kura bez enzīma notiktu daudzos miljonos gadu, notiek dažās milisekundēs. Liela daļa enzīmu ir ļoti specifiski attiecībā uz substrātu un katalizējamo reakciju. Piemēram, enzīms invertāze katalizē tikai saharozes hidrolīzi par glikozi un fruktozi. Citi enzīmi ir mazāk specifiski – piemēram, gremošanas traktā satopamais himotripsīns hidrolizē ne tikai peptīdsaites dažādos proteīnos, bet arī esterus.
Metaboliskais ceļš ir organismā veikto reakciju kopums, lai sintezētu vai noārdītu noteiktu ķīmisko savienojumu. Piemēram, glikolīze ir ķīmisks process glikozes noārdīšanai līdz piruvātam, kam nepieciešamas desmit secīgas ķīmiskas reakcijas. Izšķir anaboliskos un kataboliskos metaboliskos ceļus, kuri paredzēti attiecīgi vielu sintēzei vai noārdīšanai. Glikolīze ir kataboliskais ceļš, bet glikozes sintēze (glikoneoģenēze) – anaboliskais. Dažādi metaboliskie ceļi savā starpā ir savienoti – piemēram, glikolīze ir savienota ar trikarbonskābju jeb Krebsa ciklu, kurš savukārt savienots ar oksidatīvo fosforilēšanu. Visu trīs minēto metabolisko ceļu rezultātā glikoze tiek oksidēta līdz ogļskābajai gāzei un ūdenim, kā arī tiek saražota enerģija ATF veidā. Iegūtā ATF enerģija var tikt izmantota citos metaboliskajos ceļos – piemēram, aminoskābju un proteīnu biosintēzē.
Bioķīmiskie pētījumi balstās uz laboratorijas eksperimentiem, kuru veikšanai tiek izmantots plašs metožu klāsts. Svarīgas ir biomolekulu analīzes metodes – optiskā spektrometrija, hromatogrāfija, elektroforēze, masspektrometrija, rentgenstruktūranalīze, kodolmagnētiskā rezonanse, elektronu mikroskopija. Lai izpētītu biomolekulu ceļus un pārvērtības organismā, izmanto radioaktīvās un fluorescentās iezīmēšanas metodes. Bioķīmiskajiem pētījumiem plaši pielieto arī molekulārās bioloģijas metodes – piemēram, polimerāzes ķēdes reakciju (Polymerase Chain Reaction, PCR), DNS sekvencēšanu, molekulāro klonēšanu.
Vēl 19. gs. sākumā uzskatīja, ka dzīvībai un organiskajām vielām piemīt īpašs spēks – vitalitāte. Saskaņā ar vitālisma idejām, organiskās vielas spēj sintezēt tikai dzīvie organismi un tās nav iespējams iegūt laboratorijā no neorganiskajām vielām. 1828. gadā vācu ķīmiķim Frīdriham Vēleram (Friedrich Wöhler) izdevās sintezēt vienkāršu organisko savienojumu – urīnvielu (CO(NH2)2), pierādot, ka vitālisma ideja ir nepareiza. Par bioķīmijas kā zinātnes nozares sākumu uzskata 1833. gadu, kad franču ķīmiķis Anselms Paijens (Anselme Payen) atklāja pirmo zināmo enzīmu – diastāzi, kas hidrolizē cieti. Nozīmīgs pavērsiens bija vācu ķīmiķa Justusa fon Lībiga (Justus Freiherr von Liebig) darbs “Dzīvnieku ķīmija; jeb Organiskās ķīmijas pielietojumi fizioloģijā un patoloģijā” (Animal chemistry; or, Organic chemistry in its applications to physiology and pathology, 1842), kurā tika prezentēta metabolisma teorija. Citi pētnieki par bioķīmijas dzimšanas brīdi uzskata 1897. gadā publicēto vācu ķīmiķa Eduarda Buhnera (Eduard Buchner) pētījumu “Alkohola fermentācija bez rauga šūnām” (Alkoholische Gährung ohne Hefezellen), kurā tika parādīts, ka raugu šūnu ekstrakts spēj veikt alkohola fermentāciju bez dzīvu šūnu klātbūtnes.
Pateicoties dažādu metožu attīstībai, bioķīmija sāka strauji progresēt 20. gs. vidū. Nozīmīgi notikumi bija metabolisko ceļu glikolīzes un trikarbonskābju cikla atklāšana 20. gs. 20. un 30. gados. Svarīgs pagrieziena punkts bioķīmijas vēsturē 20. gs. 50. gados bija amerikāņu biologa Džeimsa Vatsona (James Dewey Watson), britu biologa Frānsisa Krika (Francis Harry Compton Crick), britu fiziķa Morisa Vilkinsa (Maurice Hugh Frederick Wilkins) un britu ķīmiķes Rozalindas Franklinas (Rosalind Elsie Franklin) DNS dubultspirāles atklāšana (Nobela prēmija, 1962), kas iezīmēja bioķīmijas apakšnozares – molekulārās bioloģijas dzimšanu.
1961. gadā amerikāņu zinātnieks Kristians Anfinsens (Christian Boehmer Anfinsen) eksperimentos ar ribonukleāzi A demonstrēja, ka informācija par proteīnu trīsdimensionālo struktūru iekodēta to aminoskābju sekvencē. Attīstoties proteīnu rentgenstruktūranalīzei, 20. gs. otrajā pusē un 21. gs. sākumā nozīmīgi atklājumi tika veikti strukturālajā bioķīmijā. Britu bioķīmiķi Džons Kendrjū (John Kendrew) un Makss Perucs (Max Ferdinand Perutz) noskaidroja proteīnu struktūru hemoglobīnam un mioglobīnam (Nobela prēmija, 1962), bet vācu bioķīmiķi Johans Deizenhofers (Johann Deisenhofer), Roberts Hūbers (Robert Huber) un Hartmuts Mihels (Hartmut Michel) – baktēriju fotosintētiskā centra struktūru (Nobela prēmija, 1988). Amerikāņu bioķīmiķis Rodžers Kornbergs (Roger David Kornberg) atklāja transkripcijas molekulāro mehānismu (Nobela prēmija, 2006).
Kopš bioķīmijas pirmsākumiem sasniegts nozīmīgs progress – noskaidrota daudzu biomolekulu uzbūve, mijiedarbības un metaboliskie ceļi dažādos organismos. Bioķīmijas atklājumi pielietoti neskaitāmu medicīnisku preparātu (piemēram, insulīna, kas tiek lietots diabēta ārstēšanā jau kopš 1922. gada) radīšanā, biotehnoloģijā (piemēram, insulīna ražošanā ar biotehnoloģiskām metodēm), lauksaimniecībā (piemēram, ģenētiski modificētu augu radīšanā) un citās nozarēs. Paredzams, ka turpmāk jauniem pētījumiem bioķīmijā būs būtiska nozīme gan dzīvības zinātņu turpmākajā progresā, gan arī jaunās starpdisciplinārās nozarēs – piemēram, nanobiotehnoloģijā, biodatoru, biomehatronikas un bionikas attīstībā.
Pētījumi bioķīmijas jomā notiek lielākajā daļā pasaules vadošo universitāšu, kā arī daudzos zinātniskajos institūtos. Piemēram, Oksfordas Universitātē (Oxford University), Kembridžas Universitātē (Cambridge University) – Lielbritānijā; Jeila Universitātē (Yale University), Hārvarda Universitātē (Harvard University), Kornela Universitātē (Cornell University), Kalifornijas Universitātē Bērklijā (University of California, Berkeley), Skripsa izpētes institūtā (Scripps Research Institute) ASV, Maksa Planka institūtos (Max-Planck-Institut) Vācijā, Karolinskas institūtā (Karolinska Institutet) Zviedrijā, Eiropas Molekulārās Bioloģijas Laboratorijā (European Molecular Biology Laboratory, EMBL) vairākās Eiropas valstīs, Fizikālās un ķīmiskās izpētes institūtā Riken (理化学研究所) Japānā.
Bioķīmiskie pētījumi tiek publicēti daudzos zinātniskos izdevumos, kuru kopskaits sniedzas vairākos simtos. No tiem nozīmīgākie ir vispārējie zinātnes izdevumi Science (kopš 1880. gada, American Association for the Advancement of Science), Nature (kopš 1869. gada, Nature Publishing Group) un Proceedings of the National Academy of Sciences (kopš 1914. gada, National Academy of Sciences), kā arī specializētie izdevumi, piemēram, Cell (kopš 1974. gada, Cell Press), Journal of Biological Chemistry (kopš 1905. gada, American Society for Biochemistry and Molecular Biology).
Kaspars Tārs "Bioķīmija". Nacionālā enciklopēdija. https://enciklopedija.lv/skirklis/-bio%C4%B7%C4%ABmija (skatīts 26.02.2026)