Kobalts ķīmisko elementu periodiskajā tabulā tiek apzīmēts ar simbolu Co un atrodas 4. perioda 9. grupā (pārejas metāli). Kobalta relatīvā atommasa ir 58,933. Tā atoms sastāv no 27 protoniem un 27 elektroniem (elektronu konfigurācija [Ar] 3d74s2). Kobalts ir ciets, spožs un trausls metāls sudrabaini baltā krāsā. Tas ir viens no trim metāliem (bez dzelzs un niķeļa), kas ir feromagnētiski istabas temperatūrā. Kobaltam zināms tikai viens stabilais izotops, kas sastopams dabā, – kobalts-59. Kobalts veido 0,001 % no Zemes garozas. Viens no kobaltu saturošiem savienojumiem ir vitamīns B12 jeb kobalamīns, kas ir vienīgais vitamīns, kas satur metāla atomu. Zilos pigmentus uz kobalta bāzes (kobalta zilais, cobalt blue) kopš seniem laikiem izmanto juvelierizstrādājumu un krāsu izgatavošanā, kā arī, lai stiklam piešķirtu zilu nokrāsu.
Saistītie šķirkļi

Kobalts.
Kobalta savienojumi izmantoti gadsimtiem ilgi, stiklam, glazūrai un keramikai piešķirot piesātinātu zilu krāsu. Kobalts atrodams Ēģiptes skulptūrās, persiešu rotaslietās (ap 3000. gadu p. m. ē.), Pompeju drupās (kas iznīcināta 79. gadā). Ēģiptiešu faraona Tutanhamona (twt-ˤnḫ-ı͗mn; ap 1350. gadu p. m. ē.) kapā atrasts neliels stikla priekšmets, kas iekrāsots ar kobaltu dziļi zilā krāsā. Vēl senāk kobalta zilais bija pazīstams Ķīnā, kur to izmantoja keramikas glazūrām. Vārds “kobalts” atvasināts no vācu kobold, kas nozīmē ‘goblins’ – termins, ko kalnrači lietoja kobalta rūdas apzīmēšanai. Tikai 1730. gadā zviedru ķīmiķis Georgs Brants (Georg Brandt), pētot tumši zilu rūdu no vietējām vara atradnēm, pierādīja, ka tajā ir līdz šim nezināms metāls. Rezultātus G. Brants publicēja 1739. gadā. G. Brants pierādīja, ka stikla zilās krāsas avots, ko iepriekš attiecināja uz kobaltā sastopamo bismutu, bija kobalta metāla savienojumi. Kobalts kļuva par pirmo atklāto metālu kopš dzelzs laikmeta.
Kobalts, kaut arī dabā plaši izkliedēts, veido tikai 0,001 procentus no Zemes garozas. Uz Zemes kobalts metāliskā veidā nepastāv, kam par iemeslu ir skābekļa klātbūtne atmosfērā un hlora klātbūtne okeānu ūdeņos. Nelielos daudzumos kobalts sastopams sauszemes un meteorītiskas izcelsmes niķeļa–dzelzs sastāvā, Saules un zvaigžņu atmosfērā, kombinācijā ar citiem elementiem dabiskos ūdeņos, ferromangāna garozā dziļi okeānos, augsnē, augos, dzīvniekos, kā arī minerālos – kobaltītā (CoAsS), linnaeītā (Co+2Co+32S4), skutterudītā (CoAs3), smaltītā ((Co,Fe,Ni)As2), heterogenītā (Co3+O(OH)) un eritrītā (Co3(AsO4)2·8H2O). Dzīvnieku organismā kobalts sastopams kā mikroelements B12 vitamīna veidā, kas ir būtisks atgremotāju (liellopu, aitu) uzturā un cilvēka sarkano asins šūnu nobriešanā. Kobalta rūdu parasti neizmanto paša kobalta iegūšanai. Kobalts lielākoties tiek iegūts kā blakusprodukts dzelzs, niķeļa, vara, sudraba, mangāna, cinka un arsēna rūdu iegūšanas procesā. Kobalta koncentrēšanai un iegūšanai no šīm rūdām ir nepieciešama sarežģīta apstrāde. Līdz 21. gs. otrajai desmitgadei Kongo Demokrātiskā Republika (KDR), Ķīna, Kanāda un Krievija bija pasaulē vadošās kobalta ražotājvalstis.
Kobalts-59 ir vienīgais kobalta stabilais izotops, kā arī vienīgais izotops, kas sastopams dabā. Zināmi 22 kobalta radioizotopi. Stabilākais no tiem ir kobalts-60 ar pussabrukšanas periodu 5,2714 gadi, tam seko kobalts-57 ar pussabrukšanas periodu 271,8 dienas, kobalts-56 ar pussabrukšanas periodu 77,27 dienas un kobalts-58 ar pussabrukšanas periodu 70,86 dienas. Pārējo kobalta radioizotopu pussabrukšanas periodi ir īsāki par 18 stundām, dažiem pat īsāki par vienu sekundi.
Kobalts ir ciets, spožs un trausls metāls sudrabaini baltā krāsā ar relatīvo atommasu 58,933. Kobalts ir viens no trim metāliem, kas ir feromagnētiski istabas temperaturā. Tā īpatnējais svars ir 8,9; Kirī temperatūra ir 1115 °C. Pēc fizikālām īpašībām tas līdzīgs dzelzij un niķelim. Tā blīvums cietā stāvoklī istabas temperatūrā ir 8,90 g/cm3, šķidrā stāvoklī (kušanas punktā) – 8,86 g/cm3 (dati no “CRC Ķīmijas un fizikas rokasgrāmatas, 95. izdevuma” (CRC Handbook of Chemistry and Physics. 95th Edition) Viljama Heinsa (William Mickey Haynes) redakcijā). Kobalta kušanas temperatūra (1495 oC) ir gandrīz divreiz zemāka par tā viršanas temperatūru (2927 oC). Kobalta atoma kovalentais rādiuss ir 126±3 pm, savukārt tā elektronegativitātes vērtība ir 1,88.

Ķīmiskais elements – 99,9 % metāliskais kobalts uz balta fona.
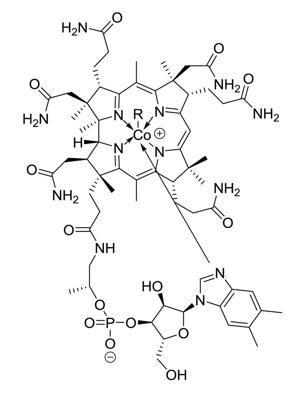
Vitamīna B12 ķīmiskā struktūra.
Kobalts ir ķīmiski aktīvs elements, ko satur liels klāsts savienojumu. Kobalts ir stabils gaisā, to neietekmē ūdens klātbūtne, taču tas šķīst atšķaidītās minerālskābēs. Smalki sadalīts kobalts spontāni uzliesmo. Lielāki kobalta gabali gaisā ir relatīvi inerti, bet virs 300 °C notiek oksidēšanās (degšana). Kobalts nereaģē ar ūdeņradi vai slāpekli, bet paaugstinātā temperatūrā reaģē ar oglekli, fosforu vai sēru. Kobalts paaugstinātā temperatūrā reaģē arī ar skābekli un ūdens tvaiku, kā rezultātā veidojas kobalta oksīds (CoO). Kobalts veido vairākus skābekli saturošus savienojumus: kobalta oksīdu (CoO), trikobalta tetraoksīdu (Co3O4) un kobalta hidroksīdu (Co(OH)3). Kobalta oksīdi zemās temperatūrās ir antiferomagnētiski. Savienojumos kobalts gandrīz vienmēr sastopams ar oksidēšanās pakāpi +2 vai +3, lai gan ir zināmas arī -3, -1, 0, +1, +4 un +5 oksidēšanās pakāpes. Parasti vienkāršos savienojumos kobalta oksidēšanās pakāpe ir +2. Kobalta sāļi ūdenī veido rozā krāsas metāla-ūdens kompleksu [Co(H2O)6]2+. Ir zināmi četri kobalta dihalīdi: kobalta fluorīds (CoF2, sārts), kobalta hlorīds (CoCl2, zils), kobalta bromīds (CoBr2, zaļš), kobalta jodīds (CoI2, zili melns). Šie halogenīdi pastāv bezūdens un hidratētā formā. Gan Co2+, gan Co3+ veido vairākus kompleksus savienojumus. Kompleksu koordinācijas skaitlis parasti ir seši. Viens no plaši pazistamajiem kobalta kompleksiem ir vitamīns B12 jeb kobalamīns. Tas ir metālorganisks savienojums, kas sastopams dabā, un vienīgais vitamīns, kas satur metāla atomu.
Trikobalta tetraoksīds (Co3O4) satur kobaltu gan +2, gan +3 oksidēšanās pakāpēs un veido līdz 40 % no komerciāli ražotā kobalta oksīda, ko izmanto keramikas, stikla un emaljas ražošanā, kā arī katalizatoru un kobalta metāla pulvera ražošanā. Viens no svarīgākajiem kobalta sāļiem ir sulfāts (CoSO4), ko izmanto galvanizācijā, žāvēšanas līdzekļu sagatavošanā un lauksaimniecībā. Citiem kobalta sāļiem ir ievērojams pielietojums katalizatoru, žāvētāju, kobalta metāla pulveru un citu sāļu ražošanā. Kobalta hlorīds (CoCl2∙6H2O) tiek izmantots katalizatoru sagatavošanā un kā mitruma indikators. Kobalta fosfātu Co3(PO4)2∙8H2O izmanto porcelāna un stikla krāsošanai.
Metāliskais kobalts tiek izmantots sakausējumos (gāzu turbīnu, gaisa kuģu detaļu virssakausējumos, korozijizturīgos sakausējumos, ātrgaitas tēraudos), magentos un magnētiskajos ierakstīšanas līdzekļos, kā katalizators naftas un ķīmijas rūpniecībā, kā arī kā sastāvdaļa krāsu žāvētājos un tintē. Kobalta zilais ir svarīga mākslinieku paletes sastāvdaļa, un to izmanto amatnieki porcelāna, keramikas, vitrāžas, flīžu un emaljas rotaslietās. Radioaktīvo izotopu kobalts-60 izmanto ārstniecībā un pārtikas apstarošanai, lai saglabātu pārtiku. Kobaltu izmanto arī cieti sakausētos sakausējumos, instrumentu tēraudos, sakausējumos ar zemu izplešanos (stikla un metāla blīvējumos) un nemainīga moduļa (elastīgos) sakausējumos. Kobalts ir vispiemērotākā matrica cementētiem karbīdiem.
Viktorija Vitkovska "Kobalts". Nacionālā enciklopēdija. https://enciklopedija.lv/skirklis/-kobalts (skatīts 07.03.2026)