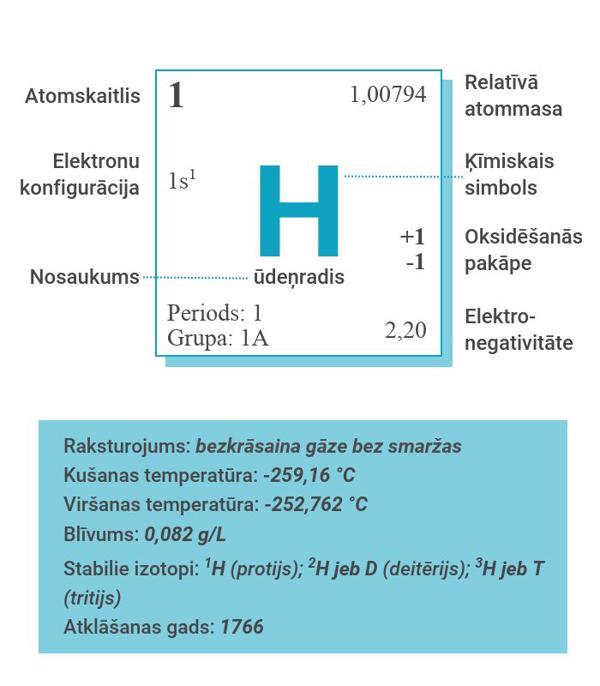
Ūdeņradis ķīmisko elementu periodiskajā tabulā tiek apzīmēts ar simbolu H un atrodas 1. perioda 1A. grupā. Ūdeņraža atoms sastāv no viena protona un viena elektrona (elektronu konfigurācija 1s1). Tas ir vieglākais elements visā periodiskajā tabulā (H relatīvā atommasa ir 1,00794 g/mol) un visizplatītākais elements Visumā, jo ir apmēram 74 % no Visuma masas. Standarta apstākļos ūdeņradis ir bezkrāsaina, viegli uzliesmojoša, netoksiska divatomu gāze bez smaržas. Tā ķīmiskā formula (H2) sastāv no diviem ūdeņraža atomiem. Ūdeņraža plazma iekrāsojas spoži violetā krāsā.
Rūpnieciski ūdeņradi iegūst ūdens tvaika katalītiskās reakcijās ar metānu, oglekļa monoksīdu (CO) vai oglekli (koksu).