Rodijs ķīmisko elementu periodiskajā tabulā tiek apzīmēts ar simbolu Rh un atrodas 5. perioda 9B. grupā (pārejas metāli). Rodija relatīvā atommasa ir 102,9055 u, un tā atoms sastāv no 45 protoniem un 45 elektroniem (elektronu konfigurācija [Kr] 4d85s1). Rodijs ir viens no retākajiem metāliem uz Zemes. Tas ir platīna grupas ciets, izturīgs pret koroziju un ķīmiski inerts cēlmetāls sudrabaini baltā krāsā ar metāliem raksturīgu spīdumu. Rodijam ir tikai viens dabā sastopams izotops – rodijs-103. Rodijs dabā sastopams brīvā veidā, sakausējumos ar citiem metāliem vai reti kā ķīmiskais savienojums minerālvielās. Katru gadu pasaulē iegūst apmēram 35 tonnu rodija (Globālā Platīna grupas metālu tirgus (Global Platinum Group Metals (PGM) Market) 2019. gada dati). Lielāko daļu saražotā rodija izmanto automašīnās kā katalītisko neitralizatoru, kaitīgus nesadegušo ogļūdeņražu, oglekļa monoksīda un slāpekļa oksīdu izmešus pārvēršot mazāk kaitīgās gāzēs. Rodijs tiek arī izmantots katalīzē un rotaslietu izgatavošanā.
Saistītie šķirkļi

Rodijs.
Rodiju 1803. gadā atklāja angļu ķīmiķis un fiziķis Viljams Volastons (William Wollaston). Sadarbībā ar angļu ķīmiķi Smitsonu Tennantu (Smithson Tennant) viņš nodarbojās ar tīra platīna tirgošanu, ko ieguva no Dienvidāfrikas platīna rūdas. Pirmais procesa solis bija neattīrīta platīna izšķīdināšana aqua regia (slāpekļskābes un sālsskābes maisījums). Platīns daļēji izšķīda šķīdumā, atstājot melnu atlikumu. S. Tennants, izpētot šo atlikumu, pirmo reizi izdalīja osmiju un irīdiju. Taču V. Volastons pievērsa vairāk uzmanības izšķīdināta platīna šķīdumam, kas saturēja arī pallādiju. Viņš izdalīja šos metālus ar izgulsnēšanas metodi un pāri palika sarkans šķīdums, no kura viņš ieguva rožu sarkanos kristālus. Tas bija nātrija rodija hlorīds (Na3RhCl6). No tā viņš ieguva tīra metāliskā rodija paraugu. Ņemot vērā Na3RhCl6 kristālu sarkano krāsu, metālu nosauca par rodiju, kas atvasināts no grieķu vārda rhodon ‘roze’.
Rodijs ir ārkārtīgi reti sastopams metāls, un tā saturs Zemes garozā ir aptuveni 0,0004 miljondaļas. Rodijs dabā atrodams brīvā formā, kā arī sakausējumā ar citiem platīna grupas metāliem un zeltu. Savukārt rodija minerāli un rūdas nav ļoti izplatītas Zemes garozā. Rodijs ir sastopams tādos minerālos kā rodplumzīts un boviejīts. Komerciāli rodiju iegūst no niķeļa un platīna rūdām. Tas tiek ražots arī kā blakusprodukts urāna-235 dalīšanās kodolreakcijā, tomēr šī metode ir sarežģīta un padara komerciālā līmeņa ražošanu ar šīs metodes palīdzību diezgan neiespējamu. Lielākie rodija ražotāji atrodas Dienvidāfrikā, Kanādā un Krievijā, kur ir lieli dabiskie rodija metāla iegulumi.

Ampula ar dažiem miligramiem rodija.
Rodijam ir tikai viens dabā sastopams izotops – rodijs-103. Stabilākie radioizotopi ir rodijs-101, kura pussabrukšanas periods ir aptuveni 3,3 gadi, rodijs-102 ar pussabrukšanas periodu 207 dienas un rodijs-99 ar pussabrukšanas periodu 16,1 dienas. Zināmi vēl divdesmit citi rodija radioaktīvie izotopi, kas ir mākslīgi ražoti un kuru atomu masa svārstās no 92,926 u (rodijs-93) līdz 116,925 u (rodijs-117). Lielākajai daļai šo izotopu pussabrukšanas periods ir mazāks par stundu, izņemot rodiju-100, kura pussabrukšanas periods ir 20,8 stundas, un rodiju-105, kura pussabrukšanas periods ir 35,36 stundas. Nevienam no rodija radioizotopiem nav nekādas komerciālas vai kādas citas izmantošanas iespējas.
Rodijs ir platīna grupas ciets un izturīgs metāls sudrabaini baltā krāsā ar metāliem raksturīgu spīdumu un ar atommasu 102,9055 u. Tas ir izturīgs pret koroziju un ķīmiski inerts cēlmetāls ar augstu atstarošanas spēju. Tā blīvums cietā stāvoklī istabas temperatūrā ir 12,4 g/cm3, šķidrā stāvoklī (kušanas punktā) – 10,7 g/cm3 (dati no “CRC Ķīmijas un fizikas rokasgrāmatas, 86. izdevums” (CRC Handbook of Chemistry and Physics. 86th Edition) Deivida Lida (David R. Lide) redakcijā). Rodija kušanas temperatūra (1964 ˚C) ir gandrīz divreiz zemāka par tā viršanas temperatūru (3695 ˚C). Rodija atoma kovalentais rādiuss ir 142±7 pm, savukārt tā elektronegativitātes vērtība ir 2,28.
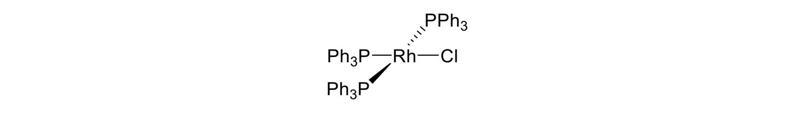
Rodijam ir deviņas oksidēšanās pakāpes: -3, -1, 0 un no +1 līdz +6, taču visbiežāk tas sastopams savienojumos, kuros tā oksidēšanās pakāpe ir +3. Rodijs ir cēlmetāls, tas nereaģē ar gaisa skābekli un ir izturīgs pret koroziju un oksidēšanos. Atšķirībā no rutēnija un osmija, rodijs neveido gaistošus skābekļa savienojumus. Rodijs ir ļoti izturīgs arī pret skābēm, tas pat nešķīst karstā koncentrētā slāpekļskābē vai sālsskābē. Visi rodija savienojumi karsējot viegli reducējas vai sadalās, iegūstot pulverveida metālu. Starp šiem savienojumiem rodija trihlorīds RhCl3 (kurā rodijs ir pakāpē +3) ir viens no vissvarīgākajiem. To izmanto par izejmateriālu daudziem citiem rodija savienojumiem pie dažādām oksidēšanās pakāpēm. Zināmie stabilie oksīdi ir Rh2O3, RhO2, RhO2×H2O, kā arī sāļi Na2RhO3, Sr3LiRhO6 un Sr3NaRhO6. Halogēna savienojumi ir zināmi gandrīz visā iespējamo rodija oksidēšanās pakāpju diapazonā. Piemēri ir rodija (III) hlorīds, rodija (IV) fluorīds, rodija (V) fluorīds un rodija (VI) fluorīds. Pie zemākām oksidēšanās pakāpēm rodija savienojumi ir stabili tikai ligandu klātbūtnē. Vispazīstamākais rodija-halogēna savienojums ir Vilkinsona katalizators (Wilkinson’s catalyst). Šo katalizatoru izmanto alkēnu hidroformilēšanai vai hidrogenēšanai.
Galvenais rodija izmantojums ir emisiju attīrīšana transportlīdzekļos. To panāk, rodijam (bieži vien kopā ar pallādiju un/vai platīnu) kaitīgo nesadegušo ogļūdeņražu, oglekļa monoksīda un slāpekļa oksīdu izmešus katalītiski pārvēršot mazāk kaitīgās gāzēs. Tā kā rodijs ir izturīgs pret koroziju, to izmanto rotu, prožektoru un spoguļu apdarē. To arī izmanto sakausējumā ar platīnu lidmašīnu turbīnu dzinēju izgatavošanā. Ķīmijas rūpniecībā rodiju izmanto kā katalizatoru dažādās hidrogenēšanas reakcijās, kā arī slāpekļskābes un etiķskābes ražošanā. Rodiju izmanto optisko šķiedru, tīģeļu, termopāra elementu un lukturu atstarotāju izgatavošanā. Tā kā tam ir zema elektriskā pretestība, to izmanto arī kā materiālu elektriskiem kontaktiem. Rodiju bieži sakausē ar platīnu un irīdiju, lai iegūtu pret oksidēšanos izturīgus sakausējumus, kas var izturēt augstas temperatūras. Šie sakausējumi tiek izmantoti krāsns tinumos, pildspalvu sprauslās, fonogrāfu adatās, augstas temperatūras termopāra un pretestības vados, lidmašīnu aizdedzes sveču elektrodos, gultņos un elektriskajos kontaktos.
Viktorija Vitkovska "Rodijs". Nacionālā enciklopēdija. https://enciklopedija.lv/skirklis/-rodijs (skatīts 26.02.2026)