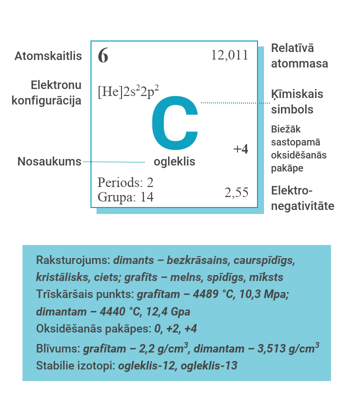
Ogleklis ķīmisko elementu periodiskajā tabulā tiek apzīmēts ar simbolu C un atrodas 2. perioda 14. grupā. Oglekļa relatīvā atommasa ir 12,011, un tā atoms sastāv no sešiem protoniem un sešiem elektroniem (elektronu konfigurācija [He] 2s22p2). Ogleklis ir elements, kas var pastāvēt vairākās formās. Pazīstamākās no tām ir dimants un grafīts. Grafīts ir viens no mīkstākajiem zināmajiem materiāliem, savukārt dimants ir viscietākais zināmais materiāls. 1985. gadā atklāta jauna oglekļa forma – fullerēns (Nobela prēmija ķīmijā 1996. gadā: atklājēji Roberts Kerls (Robert Floyd Curl, Jr.), Harolds Kroto (Sir Harold Walter Kroto), Ričards Smollijs (Richard Errett Smalley)). Ogleklis ir 17. izplatītākais elements Zemes garozā un ceturtais izplatītākais elements Visumā. Ogleklim piemīt spēja savienoties ar citiem oglekļa atomiem, veidojot sarežģītas ķēdes un gredzenus. Šī īpašība radīja organisko ķīmiju ar gandrīz neierobežotu skaitu oglekļa savienojumu. Ogleklis atrodas daudzu planētu atmosfērā, parasti kā oglekļa dioksīds (CO2).
Saistītie šķirkļi
Ogleklis
Oglekli izmantoja jau kopš seniem laikiem agrīnās cilvēku civilizācijas, visbiežāk kā kvēpus vai kokogles. Taču tikai vēlāk šie dažādie materiāli tika atzīti par viena elementa formām. 1694. gadā dabas zinātnieks Džuzepe Averani (Giuseppe Averani) un mediķis Čipriano Tardžioni (Cipriano Targioni) no Florences pirmie atklāja, ka dimantus var iznīcināt, tos sildot. Viņi koncentrēja saules gaismu uz dimantu, izmantojot lielu palielināmo stiklu, un dārgakmens pēc kāda laika pazuda. 1772. gadā Antuāns Lavuazjē (Antoine Laurent de Lavoisier) pierādīja, ka dimants ir oglekļa forma. Viņš sadedzināja kokogļu un dimanta paraugus un atklāja, ka neviens no tiem nerada ūdeni un ka vienā gramā izdalās vienāds oglekļa dioksīda daudzums. Vārds “ogleklis” cēlies no latīņu vārda carbo, kas nozīmē ‘ogles’, ‘kokogles’.
Ogleklis dabiski atrodams antracīta (akmeņogļu veids), grafīta un dimanta formā. Ogleklis un tā savienojumi ir plaši izplatīti dabā, taču tas veido tikai 0,032 % no Zemes garozas. Oglekļa savienojumi (magnija un kalcija karbonāti) veido minerālus (piemēram, magnezītu, dolomītu, marmoru vai kaļķakmeni). Koraļļi un austeru un gliemežu čaulas galvenokārt ir kalcija karbonāts (CaCO3). Ogleklis ir plaši izplatīts kā ogle vai organiskajos savienojumos, kas veido naftu, dabasgāzi un augu un dzīvnieku audus. Dabiskie dimanti ir atrodami minerālā kimberlītā, kura atradnes atrodas Krievijā, Botsvānā, Kongo Demokrātiskajā Republikā, Kanādā un Dienvidāfrikas Republikā. Ogleklis ir atrodams visās dzīvajās būtnēs. Tas atrodams arī fosilizētajās atliekās ogļūdeņražu (dabasgāzes, jēlnaftas, degslānekļa, ogļu u.c.) un karbonātu (krīta, kaļķakmeņa, dolomīta u. c.) formās.
Ogleklis piedalās vienā no svarīgākajiem bioloģiskajiem procesiem – oglekļa ciklā. Oglekļa cikls apraksta procesu, kurā oglekļa atomi nepārtraukti pārvietojas no atmosfēras uz Zemi un atpakaļ atmosfērā. Tā kā mūsu planēta un tās atmosfēra veido slēgtu vidi, oglekļa kopējais daudzums šajā sistēmā nemainās. Uz Zemes lielākā daļa oglekļa tiek uzkrāta akmeņos un nogulsnēs, bet pārējā daļa atrodas okeānā, atmosfērā un dzīvajos organismos. Ogleklis tiek izlaists atmosfērā, kad mirst organismi, izvirst vulkāni, tiek sadedzināta fosilā degviela un citos gadījumos. Okeānos ogleklis tiek pastāvīgi apmainīts starp okeāna virszemes ūdeņiem un atmosfēru vai arī tiek ilgstoši uzglabāts okeāna dziļumos. Cilvēkiem ir liela loma oglekļa apritē, kā rezultātā oglekļa dioksīda daudzums atmosfērā nepārtraukti pieaug. Mūsdienās tā koncentrācija atmosfērā ir 410 ppm, kas ir ievērojami lielāka nekā jebkurā laikā pēdējo 800 000 gadu laikā (pēc Amerikas Savienoto Valstu Nacionālās okeānu un atmosfēras administrācijas un Nacionālā klimatisko datu centra (National Oceanic and Atmospheric Administration & National Climatic Data Center, NOAA/NCDC) 2019. gada datiem: https://www.climate.gov/).
Ogleklim ir divi stabilie dabā sastopamie izotopi – ogleklis-12 un ogleklis-13. Ogleklis-12 veido 98,93 % oglekļa uz Zemes, savukārt ogleklis-13 veido atlikušos 1,07 %. 1961. gadā Starptautiskā Teorētiskās un lietišķās ķīmijas savienība (International Union of Pure and Applied Chemistry, IUPAC) par relatīvās atommasas pamatu (the basis for atomic weights) pieņēma izotopa oglekļa-12 masu. Oglekļa atomu identifikācija kodolmagnētiskās rezonanses (KMR) eksperimentos tiek veikta ar izotopu oglekli-13. Ogleklim ir zināmi 13 radioizotopi, no oglekļa-8 līdz ogleklim-22. Visstabilākais ir ogleklis-14 ar pussabrukšanas periodu 5730 gadi. Tas arī ir vienīgais dabā sastopamais oglekļa radioizotops. Stabilākais mākslīgais radioizotops ir ogleklis-11, kura pussabrukšanas periods ir 20,364 minūtes. Pārējo radioizotopu pussabrukšanas periodi ir īsāki par 20 sekundēm, lielākoties īsāki par 200 milisekundēm. Ogleklim-8 ir visīsākais pussabrukšanas periods – 2,0×10−21 s.
Ogleklim ir vairākas alotropās formas (viena ķīmiskā elementa strukturāli dažādas formas) – grafīts, dimants, fullerēni, grafēns un citi. Dimants ir bezkrāsains, caurspīdīgs, kristālisks, ciets materiāls; tas ir cietākais zināmais dabiskas izcelsmes minerāls. Turpretim grafīts ir melns, spīdīgs un mīksts. Nanoformas fullerēni un grafēns ir melni vai tumši brūni, kvēpiem līdzīgi pulveri. Katram oglekļa alotropam atšķiras fizikālās īpašības. Grafīts ir labs elektrības vadītājs, bet dimantam ir zema elektrovadītspēja. Grafīta trīskāršais punkts (vielas temperatūras un spiediena vērtības, pie kurām vienlaikus pastāv trīs agregātstāvokļa fāzes: šķidrā fāze, gāzveida fāze un cietā fāze) ir pie 4489 oC augstas temperatūras un 10,3 MPa augsta spiediena. Dimanta trīskāršais punkts ir pie 4440 oC augstas temperatūras un 12,4 GPa augsta spiediena. Grafītablīvums cietā stāvoklī istabas temperatūrā ir 2,2 g/cm3, dimanta – 3,513 g/cm3 (dati no “CRC Ķīmijas un fizikas rokasgrāmatas, 95. izdevuma” (CRC Handbook of Chemistry and Physics. 95th Edition) Deivida Lida (David R. Lide) redakcijā). Oglekļa atoma kovalentais rādiuss ir 77 pm, savukārt tā elektronegativitātes vērtība ir 2,55.

Oglekļa alotropā forma – grafīts uz balta fona.

Oglekļa alotropā forma – dimanti uz balta fona.
Oglekli grūti oksidēt, un tas nereaģē ar skābēm vai sārmiem, taču augstās temperatūrās tas veido oksīdus, no kuriem svarīgākie ir oglekļa monoksīds (CO) un oglekļa dioksīds (CO2). Augstā temperatūrā ogleklis reaģē arī ar sēra tvaikiem – veidojot oglekļa disulfīdu (CS2), ar silīciju (SiC) un dažiem metāliem – veidojot karbīdus. Ir zināmi un aprakstīti vairāk nekā miljons oglekļa savienojumu, un katru dienu šis skaitlis turpina pieaugt. Oglekļa savienojumu ir tik daudz un tie ir tik sarežģīti un svarīgi, ka to pētīšana veido specializētu ķīmijas jomu – organisko ķīmiju. Šis nosaukums izriet no fakta, ka 19. gadsimtā uzskatīja, ka lielākā daļa toreiz zināmo oglekļa savienojumu ir radušies dzīvajos organismos. Visos organiskajos savienojumos oglekļa oksidēšanās pakāpe ir +4, taču zināmi savienojumi, kur tā oksidēšanās pakāpe ir +2 (piemēram, oglekļa monoksīds (CO)). Visi organiskie savienojumi, piemēram, olbaltumvielas, ogļhidrāti un tauki, satur oglekļa atomus, un visas augu un dzīvnieku šūnas sastāv no oglekļa savienojumiem un to polimēriem. Ar ūdeņradi, skābekli, slāpekli un dažiem citiem elementiem ogleklis veido savienojumus, kas sastāda apmēram piekto daļu no visām dzīvo būtņu vielām.
Ogleklim ir daudz pielietojumu, tostarp kā dimanta rotājumam rotaslietās vai melnajam pigmentam automobiļu diskos un printera tintē. Amorfu oglekļa formu izmanto kā gāzi absorbējošu un balinošu līdzekli. Tas atrodams respiratoros un virtuves nosūcējos. Ogleklis ir unikāls starp elementiem ar savu spēju veidot stingri saistītas ķēdes, ogļūdeņražus. Šos ogļūdeņražus, ko iegūst kā fosilo kurināmo (ogli, naftu un dabasgāzi), galvenokārt izmanto kā degvielu. Neliela, bet svarīga daļa tiek izmantota kā izejviela naftas ķīmijas rūpniecībā, kas ražo polimērus, šķiedras, krāsas, šķīdinātājus un plastmasu. Ogleklis kokogles un koksa veidā tiek izmantots metālu kausēšanā dzelzs un tērauda rūpniecībā. Grafītu izmanto zīmuļos, suku izgatavošanai elektromotoros un krāsns oderēs. Oglekļa šķiedra ir plaši izmantojama kā ļoti izturīgs un viegls materiāls. Mūsdienās to izmanto tenisa raketēs, slēpēs, makšķerēs, raķetēs un lidmašīnās. Rūpnieciskos dimantus izmanto akmeņu griešanai un urbšanai. Lai aizsargātu skuvekļu asmeņus, izmanto dimanta plēves. Jaunākais oglekļa nanocaurulīšu, citu fullerēnu un plāno grafēna lokšņu atklājums ir radījis apvērsumu aparatūras attīstībā elektronikas nozarē un kopumā nanotehnoloģijās.
Viktorija Vitkovska "Ogleklis". Nacionālā enciklopēdija. https://enciklopedija.lv/skirklis/-ogleklis (skatīts 26.02.2026)