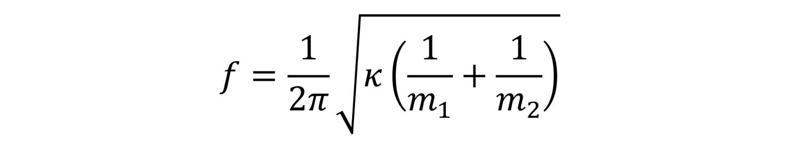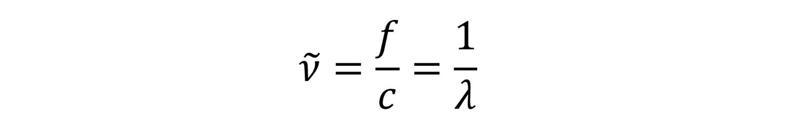Ramana efekts jeb Ramana izkliede ir optiskā starojuma neelastīgās izkliedes parādība. Elektromagnētiskā starojuma kvantam neelastīgās izkliedes laikā notiek enerģijas apmaiņa ar vielas molekulām, kā rezultātā izmainās elektromagnētiskā viļņa frekvence. Ramana spektroskopija apvieno metožu kopu, kurās tiek pētītas monohromatiska starojuma frekvences izmaiņas pēc izkliedes no pētāmā parauga. Analizējot nobīdes no krītošā starojuma frekvences, ir iespējama vielas identifikācija, ķīmiskā sastāva un struktūras analīze.
Ramana spektroskopija
Saistītie šķirkļi
Ramana spektroskopijā reģistrētās frekvenču nobīdes ir cieši saistītas ar parauga molekulu ķīmisko saišu svārstībām, tādējādi sniedzot plašu informāciju par pētāmo paraugu. Vielas molekulārās struktūras analīze ir daudzu ķīmijas, bioloģijas, fizikas un medicīnas nozaru pētījumu pamatā. Mērījumus var veikt plašam materiālu klāstam, turklāt tie ir nedestruktīvi, tādēļ tos plaši izmanto arī ārpus eksakto zinātņu pētījumiem, piemēram, produkcijas kvalitātes kontrolē, mākslas darbu analīzē, kriminālistikā un citur. Ramana mērījumiem netraucē ūdens molekulu klātbūtne, taču salīdzinājumā ar infrasarkanā starojuma spektroskopiju jutība ir zemāka. Tā kā starojuma izkliedes un absorbcijas procesi vielā ierosina atšķirīgus molekulu svārstību veidus, abas svārstību spektroskopijas metodes dēvē par komplementārām.
Mūsdienās eksistē vairāk nekā 25 metožu variācijas, kas pielāgotas dažādu problēmjautājumu risināšanai. Tās var klasificēt tradicionālajās jeb spontānās, pastiprinātās un nelineārās Ramana spektroskopijas metodēs. Plaši tiek izmantota kombinēta spektroskopijas un optiskās mikroskopijas realizācija – Ramana mikrospektroskopija – molekulu svārstību pētījumiem mikromērogā. Mūsdienās Ramana mērījumus var integrēt arī elektronu mikroskopos un skenējošās zondes mikroskopos.
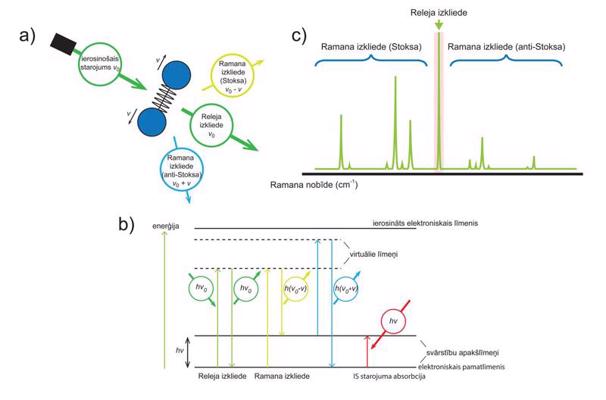
Viena no elektromagnētiskā viļņa mijiedarbības izpausmēm ar vielu ir izkliede – starojuma novirze no taisnvirziena kustības. Ar visaugstāko varbūtību norisinās elastīgās jeb Releja izkliedes (Rayleigh scattering) process, kurā starojuma kvanti savu enerģiju saglabā. Tomēr nelielai daļai gaismas kvantu var notikt enerģijas apmaiņa ar vielas daļiņām, kā rezultātā izkliede ir neelastīga un kvanta frekvence izmainās. Šādu procesu sauc par Ramana izkliedi jeb Ramana efektu.
Lai izprastu procesus, ko var ierosināt elektromagnētiskais starojums, vielas struktūra ir jāaplūko molekulārā mērogā. Viens no vienkāršākajiem ir divatomu molekulas modelis, kurā tiek pieņemts, ka atomi ir saistīti ar elastīgu saiti. Molekulas svārstību frekvenci f atbilstoši Huka likumam (Hooke’s law) var izteikt ar formulu.
Tātad svārstību frekvence būs augstāka pie lielākas spēka konstantes vērtības (stiprākas ķīmiskās saites) un mazākām atomu masām. Svārstību spektroskopijā pieņemtais frekvences raksturlielums ir viļņu skaitlis, kas raksturo viļņu skaitu garuma vienībā.
Iespējamās molekulu svārstības nosaka ne tikai atomu masas un ķīmiskās saites daba, bet arī kvantu fizikas likumsakarības. Svārstībām mikropasaulē ir iespējami tikai noteikti stāvokļi, kurus raksturo ar diskrētām enerģijas un kvantu skaitļu vērtībām. Līdz ar to svārstību frekvence ir unikāls funkcionālo grupu raksturojošs lielums, kas var kalpot kā “pirksta nospiedums” tās identifikācijā.
Tiešā veidā pārejas starp svārstību apakšlīmeņiem var ierosināt elektromagnētiskais starojums infrasarkanajā spektra daļā, kas ir infrasarkanā starojuma spektroskopijas pamatā. Ramana spektroskopijā tiek izmantots alternatīvs paņēmiens svārstību raksturošanai. Paraugu apgaismojot ar monohromatisku starojumu, fotoni, kas mijiedarbojas ar paraugu, ierosina molekulas potenciālo enerģiju virtuālā stāvoklī. Gandrīz nekavējoties lielākā daļa molekulu atgriežas pamatstāvoklī, emitējot fotonu ar tādu pašu viļņa garumu, ko novērojam kā elastīgo izkliedi. Neliela daļa no krītošajiem fotoniem stimulē pārejas starp svārstību apakšlīmeņiem, kā rezultātā izmainās to enerģija. Tādējādi, detektējot no parauga izkliedēto starojumu, ir iespējams spriest par svārstību procesiem pētāmajā vielā. Ramana spektrā tiek attēlota starojuma intensitāte atkarībā no frekvences nobīdes attiecībā pret krītošo starojumu. Visintensīvākais maksimums spektra nulles punktā atbilst elastīgās izkliedes Releja līnijai. Pārējās ir Ramana līnijas, kuras atkarībā no tā, vai frekvences nobīde ir negatīva vai pozitīva, sīkāk iedala attiecīgi Stoksa un antitoksa līnijās.
Lai svārstība būtu “Ramana aktīva” (Ramana spektrā novērojama), ir jāizpildās nosacījumam, ka tās laikā mainās saites polarizejamība. Polarizejamība raksturo molekulas elektronu mākoņa spēju deformēties ārēja elektriskā lauka klātbūtnē. Pretstatā infrasarkanā starojuma spektroskopijā aktīvas ir tikai tādas svārstības, kuru laikā mainās molekulas dipola moments, tādēļ abas svārstību spektroskopiju metodes ir komplementāras. Atļautās un aizliegtās pārejas abos gadījumos nosaka molekulas simetrija, ko skaidro, izmantojot grupu teoriju (group theory).
Ramana spektroskopijā tiek pētīta molekulu svārstību inducēta starojuma modulācija pēc tā izkliedes no pētāmā parauga. Eksperimenta veikšanai nepieciešams starojuma avots, optikas sistēma staru gaitas kontrolei, ierīce starojuma sadalīšanai spektrā, detektors un elektronikas sistēma datu pārveidošanai, uzkrāšanai un apstrādei.
Par starojuma avotu parasti tiek izmantots lāzers, kas darbojas ultravioletā (0,2‒0,4 µm; 50000‒25000 cm-1), redzamās gaismas (0,4‒0,7 µm; 25000‒14300 cm-1) vai tuvā infrasarkanā starojuma (0,7‒2,5 µm; 14300‒4000 cm-1) spektra apgabalā. Ramana spektra intensitāte var būt pat par 6‒12 kārtām mazāka nekā ierosinošajam starojumam, līdz ar to viens no tehnoloģiskajiem izaicinājumiem ir saistīts ar vājā signāla detektēšanu dominējoša signālā klātbūtnē. Vēsturiski Releja līnijas intensitātes samazināšanai veidoja vairāku monohromatoru sistēmas, taču mūsdienās šim nolūkam tiek izmantoti speciāli filtri (laser line rejection filter). Precīzu eksperimentu veikšanai nepieciešams nodrošināt lāzera jaudas un frekvences stabilitāti laikā. Traucējošs faktors mērījumu veikšanā reizēm ir parauga fluorescence, kā rezultātā vājās Ramana līnijas var nebūt pamanāmas. Viens no risinājumiem fluorescences novēršanai ir eksperimenta veikšana, izmantojot citu starojuma viļņa garumu.
Izšķir dispersijas (dispersion) un Furjē transformācijas Ramana (Fourier transform Raman, FT-Raman) instrumentus. Dispersijas tipa spektrometros izkliedētā starojuma izvērsi spektrā nodrošina monohromators ar difrakcijas režģi, savukārt signāla detektēšanai izmanto lādiņa saites matricas (charge coupled device, CCD). FT-Raman ierīcēs tiek izmantots interferometrisks signāla reģistrēšanas princips, par fotodetektoru izmantojot indija gallija arsenīda (InGaAs) vai līdzvērtīgu pusvadītāju materiālu.
Problēmas Ramana mērījumu veikšanai nesagādā gaisa sastāvā esošās ūdens tvaiku un oglekļa dioksīda molekulas. Tādējādi Ramana spektroskopija ir iespējama tādu paraugu un procesu analīzē, kuriem infrasarkanā starojuma absorbcijas spektru mērījumi ir problemātiski, piemēram, bioloģiskiem paraugiem to dabīgajā stāvoklī. Vēl viena būtiska priekšrocība ir ierosinošā starojuma spektrālais diapazons, kas ļauj staru gaitas kontrolei izmantot tradicionālās stikla vai kvarca lēcas un optiskās šķiedras. Rezultātā Ramana spektru mērījumus var salīdzinoši vienkārši integrēt optiskajā mikroskopā, lai veiktu ķīmiskā sastāva analīzi ļoti maziem paraugiem vai atsevišķiem tā punktiem. Konfokālajā Ramana mikroskopijā papildus ir iespējams iegūt informāciju par svārstību procesiem dažādos parauga dziļuma slāņos. Ramana kartēšanā (Raman mapping) dažādos parauga punktos iegūtie Ramana spektri tiek apvienoti vienā attēlā, kas satur informāciju gan par parauga struktūru, gan tā ķīmisko sastāvu. Ramana attēlveidošana (Raman imaging) ir alternatīva divdimensiju attēlu uzņemšanas metode, kurā izvēlētās Ramana spektra frekvences tiek detektētas no visa pētāmā parauga vienlaicīgi.
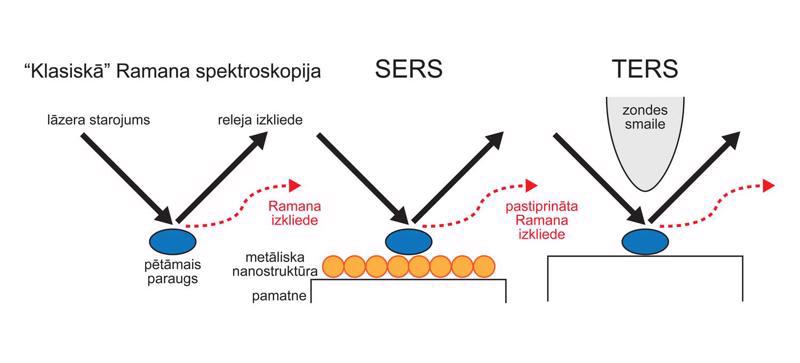
Ramana efekts ir ļoti vāja parādība, kā rezultātā ir izveidotas vairākas progresīvas metodes, kurās tas tiek pastiprināts. Rezonanses Ramana (Resonance Raman) spektroskopijā ierosinošā starojuma kvanta frekvence tiek piemeklēta tā, lai pētāmā materiāla izvēlētās molekulās tiktu ierosinātas elektroniskās pārejas. Stimulētajā Ramana spektroskopijā (stimulated Raman spectroscopy, SRS) un koherentajā antistoksa Ramana izkliedē (coherent anti-Stokes Raman scattering, CARS) pastiprinājuma efekts tiek panākts nelineāru optisku efektu rezultātā, izmantojot vairākus augstas intensitātes impulsu starojuma avotus. Virsmas pastiprinātā Ramana izkliedes (surface enhanced Raman scattering, SERS) mērījuma laikā pētāmā parauga molekulas tiek adsorbētas nanostrukturētā metāliskā pamatnē, lai lokāli pastiptinātu starojuma un vielas mijiedarbības procesus. Smailes pastiprinātajā Ramana izkliedē (tip enhance Raman scattering, TERS) mērījumi tiek integrēti skenējošās zondes mikroskopā, kas nodrošina visaugstāko Ramana spektru telpisko izšķirtspēju.
Optiskā starojuma izkliedes parādību, kuras laikā izmainītos tā frekvence, no teorētiskiem apsvērumiem 1923. gadā paredzēja austriešu fiziķis Ādolfs Smekāls (Adolf Gustav Stephan Smekal). Parādību 1928. gadā eksperimentāli atklāja indiešu fiziķi Čandrasekara Ramans (ச. வெ. இராமன், Sir Chandrasekhara Venkata Raman) un Kariamanikams Krišnans (கரியமணிக்கம் சீனிவாச கிருஷ்ணன், Sir Kariamanikkam Srinivasa Krishnan), mērot Saules starojuma izkliedi dažādos šķīdumos. Ap to pašu laiku gaismas izkliedi kvarcā pētīja un neatkarīgi iegūtos rezultātus publicēja Padomju Sociālistisko Republiku Savienības (PSRS) fiziķi Grigorijs Landsbergs (Григорий Самуилович Ландсберг) un Leonīds Mandelštams (Леонид Исаакович Мандельштам). K. Ramanam 1930. gadā piešķīra Nobela prēmiju fizikā un gaismas neelastīgās izkliedes parādību nosauca tā atklājēja vārdā. 20. gs. 30. gados sistemātisku teoriju Ramana spektru interpretācijai izveidoja čehu fiziķis Georgs Plačeks (Georg Placzek).
Sākotnējā interese Ramana spektroskopijā bija augsta, jo iestrādes eksperimentiem ar redzamo gaismu salīdzinājumā ar infrasarkano starojumu bija labākas. Dzīvsudraba lampas bija pieejami monohromatiska starojuma avoti ar augstu intensitāti; stikla elementus varēja lietot gan kā paraugturus, gan prizmas starojuma izvēršanai spektrā, un fotoplates bija piemēroti starojuma detektori. Viens no aizsācējiem dažādu ķīmisko savienojumu Ramana spektru apkopošanā bija austriešu fiziķis Karls Kolraušs (Karl Kohlrausch). Līdz 1939. gadam zinātniskajā literatūrā tika publicēti gandrīz 2000 ar Ramana efektu saistīti raksti.
Plašāku Ramana spektroskopijas pielietojamību ierobežoja vairāki būtiski metodes trūkumi – mērījumiem traucēja Releja līnijas augstā intensitāte un parauga fluorescence, kā rezultātā vājās Ramana līnijas varēja nebūt pamanāmas. Pēc Otrā pasaules kara strauji attīstījās infrasarkanās spektroskopijas instrumentācija, kā rezultātā tā kļuva par galveno molekulu svārstību analīzes metodi. Ramana spektroskopiju pārsvarā izmantoja akadēmiskiem nolūkiem.
Lāzera izgudrošana 1960. gadā bija viens no svarīgākajiem stimuliem turpmākās Ramana spektroskopijas attīstībā. Fotoplates aizstāja ar fotoelektronu pavairotājiem un vēlāk – ar lādiņa saites matricām. Releja līnijas novēršanai ieviesa vairāku monohromatoru sistēmas un speciālus filtrus. Ar fluorescenci saistītās problēmas 1986. gadā izdevās samazināt Amerikas Savienoto Valstu zinātniekiem Tomasam Hiršfīldam (Thomas Hirschfeld) un Brūsam Čeisam (Bruce Chase), Ramana spektru ierosinot ar tuvo infrasarkano starojumu. Par starojuma avotu tika izmantots ar neodīmu aktivēts itrija alumīnija granāta (Nd:Y3Al5O12; Nd:YAG) lāzers ar 1064 nm emisijas viļņa garumu. Uzlabotu tehnoloģisko risinājumu un jaunu pētniecības metožu izveides rezultātā Ramana spektroskopija ieguva jaunus pielietojumus arī ārpus fundamentālu zinātnisku pētījumu īstenošanas.
Ramana spektroskopijas metodes ir pieejamas pasaulē nozīmīgākajās dabas zinātņu nozaru pētniecības iestādēs.
Līdz ar nozīmīgo progresu optisko sistēmu komponentēs – lāzera starojuma avotos, efektīvos filtros un jutīgos CCD detektoros – Ramana spektroskopija ir kļuvusi par neatņemamu sastāvdaļu modernās zinātnes pētījumos. Ar SRS, CARS un SERS metodēm ir panākti daudzkārtīgi uzlabojumi mērījumu jutībā. Nozīmīgas ir Ramana mikroskopijas metodes, ar kurām ir iespējama nedestruktīva vielas molekulārās struktūras analīze. Tās plaši izmanto bioloģisku audu un šūnu analīzei mikromērogā. Nozīmīgi pielietojumi parādās arī medicīniskajā attēlveidošanā un diagnostikā. Mūsdienu materiālu fizikas problēmjautājumu risināšanai nepieciešams veikt mērījumus nanomērogā, kam piemērota ir TERS. Metode balstās uz Ramana mērījumiem skenējošās zondes mikroskopā, kā rezultātā ir iespējama vienlaicīga parauga virsmas topogrāfijas un lokāla ķīmisko īpašību analīze. Pašreizējie problēmjautājumi ir saistīti ar tehnoloģiskiem aspektiem, sevišķi atkārtojumu miniatūrās zondes smailes izgatavošanu. Cits nozares attīstības virziens ir kompakti un pārnēsājami instrumenti Ramana mērījumu veikšanai, ko plaši izmanto materiālu kvalitātes kontrolē, farmācijas nozarē, ģeoloģisku paraugu analīzē, kriminālistikā un citās nozarēs. 2020. gadā Science Advances publicētā rakstā ir demonstrēta Ramana spektroskopijas pielietojamība neinvazīvai glikozes līmeņa monitorēšanai asinīs. Miniatūras nēsājamas ierīces ar integrētiem glikozes sensoriem varētu uzlabot dzīves kvalitāti cilvēkiem ar cukura diabētu.
Nozīmīgi žurnāli, kuros Ramana spektroskopijas rezultāti parādās visbiežāk, ir Applied Surface Science (kopš 1984. gada; izdevējs Elsevier), Journal of Physical Chemistry C (kopš 2007. gada) un Physical Review B (kopš 1970. gada), ko izdod Amerikas Ķīmijas biedrība (American Chemical Society). Biedrība izdod arī žurnālu Journal of the American Chemical Society (kopš 1879. gada). Nozīmīgs ir arī žurnāls Nanoscale (kopš 2009. gada), ko izdod Karaliskā ķīmijas biedrība (Royal Society of Chemistry), un citi. Journal of Raman Spectroscopy (kopš 1973. gada; izdevējs Wiley-Blackwell) ir īpaši Ramana tematikai veltīts žurnāls.
Andris Antuzevičs "Ramana spektroskopija". Nacionālā enciklopēdija. https://enciklopedija.lv/skirklis/-Ramana-spektroskopija (skatīts 26.02.2026)