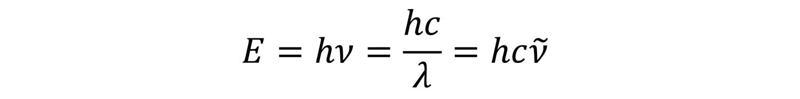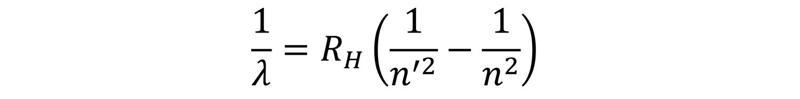Spektroskopijas eksperimentu pamatā ir starojuma absorbcijas, atstarošanās, izkliedes vai emisijas parādību raksturlielumu noteikšana pētāmajā objektā atkarībā no starojuma enerģijas. Galvenokārt tiek izmantots elektromagnētiskais starojums, taču eksistē arī spektroskopisko metožu variācijas, kurās pēta daļiņu, piemēram, elektronu, neitronu un jonu, izraisītos efektus vielā. Starojuma un vielas mijiedarbības procesu rezultātā notiek kvantu mehāniskas pārejas vielas elektroniskajā struktūrā, kas ir atkarīgas no pētāmā parauga sastāva, struktūras un īpašībām. Terminu “spektroskopija” var attiecināt gan uz zinātnes nozari, gan uz metožu kopu vai konkrētu metodi.
Saistītie šķirkļi
Nozares un apakšnozares

Zinātniece, veicot atomu absorbcijas spektroskopijas pētījumus. 2017. gads.
Spektroskopija ir stūrakmens daudzu kvantu fizikas teoriju attīstībā, tajā skaitā atoma modeļa izveidē, siltumstarojuma un fotoefekta parādību izskaidrošanā, kvantu elektrodinamikas izstrādē un citās. Spektroskopijas eksperimenti ir daudzpusīgs izziņas avots dažādu problēmjautājumu risināšanā, un tie ir neatņemami fizikas, ķīmijas, bioloģijas, astronomijas un citu nozaru pētījumos. Veicot parauga spektroskopisko analīzi, var gūt ieskatu tā atomārajā un molekulārajā struktūrā, kas nosaka vielas īpašības makromērogā un pielietojamību ikdienā. Mērījumus var veikt attālināti, tādēļ spektroskopija ir viens no primārajiem informācijas avotiem par astronomisku objektu izcelsmi, sastāvu un īpašībām. Tajā pašā laikā spektroskopijas metožu pielietojumi sniedzas arī ārpus fundamentālās zinātnes – tās izmanto medicīniskajā diagnostikā, produkcijas kvalitātes un ražošanas procesu uzraudzībā, vides piesārņojuma monitoringā, dozimetrijā, kriminālistikā, mākslas darbu analīzē un citur.
Spektroskopiju var sīkāk klasificēt pēc vairākiem kritērijiem. Pēc starojuma un vielas mijiedarbības veida izšķir absorbcijas spektroskopiju, emisijas spektroskopiju, izkliedes spektroskopiju un atstarošanās spektroskopiju. Atkarībā no pētāmā objekta var iedalīt atomu spektroskopiju, molekulu spektroskopiju, cietvielu spektroskopiju, zvaigžņu spektroskopiju u. c.
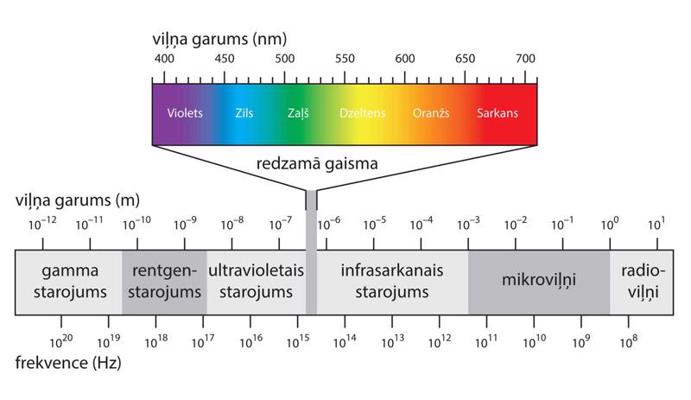
Viens no noteicošajiem faktoriem, kāda veida informācija par paraugu tiks iegūta, ir izmantotā starojuma enerģija (to var raksturot arī ar starojuma frekvenci vai viļņa garumu). Pēc izmantotā elektromagnētiskā spektra diapazona izšķir radiofrekvenču spektroskopiju, mikroviļņu spektroskopiju, infrasarkanā (IS) starojuma spektroskopiju, redzamās gaismas spektroskopiju, ultravioletā (UV) starojuma spektroskopiju, rentgenstaru spektroskopiju un gamma starojuma spektroskopiju. Optiskajā spektroskopijā tiek pētīti procesi spektra diapazonā, kas ietver redzamās gaismas (400–700 nm), daļu no UV (10–400 nm) un IS (700 nm–1 mm) starojuma apgabaliem. Optiskās spektroskopijas apakšklasi veido svārstību spektroskopija – IS starojuma spektroskopija un Ramana spektroskopija. Magnētiskās rezonanses spektroskopija ietver kodolu magnētiskās rezonanses (KMR) spektroskopiju un elektronu paramagnētiskās rezonanses (EPR) spektroskopiju. Eksperimentus var veikt ne tikai ar elektromagnētisko starojumu, bet arī izmantojot citus starojuma veidus (elektronu spektroskopija, neitronu spektroskopija u. c.).
Starojuma izraisītos procesus vielā skaidro kvantu fizika. Viens no svarīgākajiem elektromagnētiskā viļņa un gaismas kvanta – fotona – raksturlielumiem ir enerģija E:
Fotona absorbcija vai emisija vielā ir saistīta ar pētāmās sistēmas pāreju starp diskrētiem kvantu stāvokļiem. Iespējamos stāvokļus nosaka kvantu mehānikas likumsakarības – tos raksturo ar noteiktām kvantu skaitļu un enerģijas vērtībām. Ja fotona enerģija sakrīt ar enerģijas starpību starp diviem kvantu stāvokļiem, var tikt ierosināta rezonanses pāreja. Spektroskopisko pētījumu pamatā ir absorbēto vai emitēto fotonu enerģiju noteikšana, kas sniedz ieskatu pētāmās vielas elektroniskajā struktūrā.
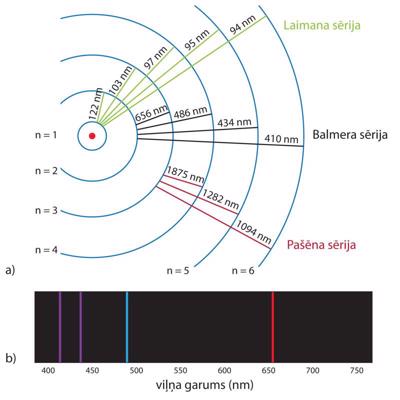
Viens no vienkāršākajiem modeļiem spektroskopisko pamatprincipu ilustrācijai ir ūdeņraža atoms. Kā periodiskās tabulas pirmajam elementam ūdeņraža atoma sastāvā ir viens protons un viens elektrons. Saskaņā ar Bora atoma modeli protons veido atoma kodolu, savukārt elektrons riņķo orbītā ap to. Elektronam ir atļauts atrasties tikai noteiktās orbītās, starp kurām tas var “pārlēkt”, absorbējot vai izstarojot atbilstošas enerģijas fotonu. Redzamās gaismas diapazonā ūdeņraža emisijas spektrā novēro četras spektrāllīnijas, kas atbilst elektrona pārejām no ierosinātiem stāvokļiem, kuru galvenā kvantu skaitļa vērtības ir n = 3, 4, 5, 6, uz stāvokli ar galveno kvantu skaitli n’ = 2. Spektrāllīniju viļņa garumu var aprēķināt, izmantojot Ridberga (Rydberg) formulu:
Spektrāllīniju sēriju no ierosinātiem stāvokļiem uz stāvokli ar n’ = 2 sauc par Balmera sēriju (Balmer series). Ūdeņraža spektrā var novērot arī pārejas, kur n’ = 1 (Laimana sērija – Lyman series), n’ = 3 (Pašēna sērija – Paschen series) un citas.
Iespējamos kvantu mehāniskos stāvokļus un līdz ar to – spektroskopiskās īpašības, nosaka pētāmās sistēmas atomārā struktūra. Ķīmiskie elementi savā starpā atšķiras ar atomu veidojošo daļiņu – protonu, neitronu un elektronu – skaitu, kā rezultātā katram elementam ir unikāls elektronu čaulu aizpildījums, un spektroskopiskās pārejas var kalpot kā “pirkstu nospiedums” vielas identifikācijā. Ja atomi ir savstarpēji saistīti ar ķīmiskām saitēm, izveidojot molekulu, tie var papildus svārstīties ap savām līdzsvara pozīcijām. Molekulu svārstības arī ir kvantētas, tas ir, katram svārstību veidam ir noteiktas svārstību frekvences, kas ir atkarīgas no molekulu veidojošo atomu masām un ķīmiskās saites stipruma. Molekulām gāzveida stāvoklī papildus izšķir enerģijas līmeņu struktūru, kas saistīta ar to rotācijas kustību. Šķidrumos un cietvielās jāņem vērā cieši izvietotu atomu savstarpējie mijiedarbības spēki. Šādās sistēmās kvantu stāvokļu enerģijas ir tik cieši izvietotas, ka to aprakstam praktiskāk ir ieviest enerģijas zonu (band) jēdzienu.
Vielā ierosinātie procesi ir atkarīgi no elektromagnētiskā starojuma kvantu enerģijas. Optiskā starojuma diapazonā (UV starojums, redzamā gaisma, tuvais IS starojums) var ierosināt elektroniskās pārejas vājāk saistītajos valences elektronos. Izmantojot augstākas enerģijas rentgenstaru kvantus, ir iespējams jonizēt atoma iekšējo čaulu elektronus. Gamma staru absorbcija un emisija ir saistīta ar procesiem atoma kodolā. Ar atomu savstarpējām svārstībām saistītos procesu spektroskopiskās pārejas var novērot IS starojuma diapazonā. Molekulu rotāciju gāzēs pēta ar mikroviļņu starojumu. Elektroniem un atomu kodoliem piemīt iekšējs kustības daudzuma moments jeb spins. Pārejas starp spina apakšlīmeņiem tiek pētītas ārējā magnētiskajā laukā, izmantojot mikroviļņu vai radiofrekvenču starojumu. Starojuma inducētie procesi ir jutīgi arī pret spektroskopiski aktīvā centra tuvāko apkārtni. Tādējādi spektroskopiskie mērījumi ir informācijas avots par struktūru un notiekošajiem procesiem pētāmajā objektā atomārā mērogā.
Dažādo spektroskopisko metožu pamatidejai un realizācijai pirmajā tuvinājumā ir daudz kopīga. Vielas-starojuma mijiedarbības procesu raksturošanai, pirmkārt, ir nepieciešams starojuma avots un detektors. Spektru tipiski veido detektorā reģistrētā signāla intensitāte atkarībā no starojuma viļņa garuma (frekvences vai enerģijas), tādēļ būtisks ir elements, kas nodrošina starojuma izvērsi spektrā. Spektrometra sastāvā nepieciešama arī sistēma kontrolētai starojuma novirzīšanai uz pētāmo paraugu un detektoru, kā arī sistēmas vadības elektronika. Lai gan spektroskopijas metodes konceptuāli ir līdzīgas, izmantotais spektrālais apgabals nosaka daudzas tehniskas nianses un pētāmo problēmjautājumu klāstu.
Optiskās spektroskopijas metodes ir ļoti daudzveidīgas, jo tās aptver plašu elektromagnētiskā spektra diapazonu (redzamā gaisma, UV un IS starojums). No starojuma un vielas mijiedarbības veida izdala absorbcijas spektroskopijas (absorption spectroscopy) un emisijas spektroskopijas (emission spectroscopy) metodes. Absorbciju vielā var noteikt, mērot paraugam cauri izgājušo (transmittance) vai analizējot no parauga virsmas atstaroto (reflectance) starojumu. Starojuma emisija no vielas tiek pētīta ar luminiscences spektroskopijas metodēm. Galvenais kritērijs, pēc kura sīkāk klasificē luminiscences spektroskopijas metodes ir luminiscences ierosmes veids. Atsevišķi tiek izdalītas optiskās spektroskopijas metodes molekulāro svārstību pētījumiem. IS starojuma spektroskopijā pārejas starp molekulu svārstību apakšlīmeņiem tiek ierosinātas tiešā veidā – starojuma absorbcijas rezultātā. Ramana spektroskopijā informācija par vielā notiekošajiem svārstību procesiem tiek iegūta, analizējot frekvenču nobīdes starp krītošo un neelastīgi izliedēto starojumu. Optiskās spektroskopijas eksperimenti var tikt integrēti optiskajos un skenējošās zondes mikroskopos, lai veiktu pētījumus mikro- un nano- mērogos.
Spektroskopijas metodes, kurās izmanto jonizējošo elektromagnētisko starojumu – rentgenstarus vai gamma starojumu –, ļauj spriest strukturālām niansēm atomārā mērogā. Šādu spektroskopisko pētījumu veikšanai nepieciešami piemēroti starojuma avoti (rentgenlampas, sinhrotroni, radioaktīvās kodolsabrukšanas reakcijas) un detektori (gāzizlādes skaitītāji, scintilatori, pusvadītāju ierīces). Rentgenstaru spektroskopiju, līdzīgi kā optisko spektroskopiju, var vispārīgi klasificēt absorbcijas spektroskopijā (X-ray absorption spectroscopy, XAS) un emisijas spektroskopijā (X-ray emission spectroscopy, XES). Gamma staru spektroskopijā viens no centrālajiem problēmjautājumiem ir dažādu avotu emitētā gamma starojuma spektrālā analīze. Cietvielu pētījumos plaši izmanto Mesbauera spektroskopijas (Mössbauer spectroscopy) metodes, kuru pamatā ir rezonanses gamma staru emisijas un absorbcijas parādība.
Magnētiskās rezonanses spektroskopijas metodēs tiek izmantots zemas enerģijas elektromagnētiskais starojums, lai raksturotu vielā notiekošos procesus ārēja magnētiskā lauka klātbūtnē. Selektīvu radiofrekvenču absorbciju atomu kodolos ārējā magnētiskā laukā pēta ar KMR spektroskopiju. KMR ir viena no centrālajām metodēm ķīmisku savienojumu identifikācijā un kvantificēšanā; to izmanto arī medicīniskajā diagnostikā magnētiskās rezonanses tomogrāfijā. EPR, izmantojot mikroviļņu starojumu, tiek pētītas sistēmas ar nesapārotiem elektroniem. EPR spektroskopija ir visinformatīvākā metode paramagnētisku centru lokālās struktūras analīzei, tādēļ to plaši izmanto fundamentālajā zinātnē.
Elektronu spektroskopijā informācijas avots par vielu ir elektroni, nevis fotoni. Fotoelektronu spektroskopijā (photoelectron spectroscopy, PES) tiek izmantots elektromagnētiskais starojums, lai no vielas virsmas atrautu elektronus. Atkarībā no izmantotā spektrālā diapazona izšķir ultravioleto fotoelektronu spektroskopiju (ultraviolet photoelectron spectroscopy, UPS) un rentgenstaru fotoelektronu spektroskopiju (X-ray photoelectron spectroscopy, XPS). Ožē elektronu spektroskopijā (Auger electron spectroscopy, AES), pretstatā, tiek pētīti primārā elektronu kūļa iedarbības rezultātā emitētie elektroni. Elektronu spektroskopijas eksperimentus iespējams veikt modernos elektronu mikroskopos – viena no variācijām ir elektronu enerģijas zudumu spektroskopija (electron energy loss spectroscopy, EELS), kas ir piemērota ķīmisko elementu sadalījuma analīzei paraugā ar atomāru izšķirtspēju.
Pirmie spektroskopiskie novērojumi un pētījumi tika veikti optiskā starojuma diapazonā. 17. gs. otrajā pusē sers Īzaks Ņūtons (Sir Isaac Newton) veica virkni eksperimentu ar redzamo gaismu, tajā skaitā, demonstrēja baltās gaismas sadalīšanos spektrā. Viens no pirmajiem spektroskopisko pētījumu objektiem bija Saules starojums. 1800. gadā britu zinātnieks Viljams Heršels (Frederick William Herschel) atklāja, ka daļu no Saules spektra veido cilvēkiem neredzams infrasarkanais starojums. 1801. gadā līdzīgus novērojumus uz īsāku viļņa garumu pusi veica vācu zinātnieks Johans Ritters (Johann Wilhelm Ritter), atklājot ultravioleto spektra apgabalu. Detalizētu Saules spektra izpēti un absorbcijas joslu tabulāciju 19. gs. sākumā veica vācu fiziķis Jozefs fon Fraunhofers (Joseph Ritter von Fraunhofer). Fraunhofera līniju sasaisti ar ķīmiskiem elementiem raksturīgu absorbciju veica vācu zinātnieki Gustavs Kirhofs (Gustav Robert Kirchhoff) un Roberts Bunsens (Robert Wilhelm Eberhard Bunsen), kas lika pamatus vielas sastāva spektroskopiskai analīzei.
Kvantu fizikas teoriju attīstība 20. gs. pirmajā pusē pavēra iespējas spektru intepretācijai. Viens no pētījumu problēmjautājumiem bija spektrāllīniju izcelsme ūdeņraža atomā. Šim jautājumam pievērsās tādi atpazīstami zinātnieki kā Anders Angstrēms (Anders Jonas Ångström), Johans Balmers (Johann Jakob Balmer), Johans Ridbers (Johannes Robert Rydberg) un citi. 1913. gadā dāņu fiziķis Nīls Bors (Niels Bohr) prezentēja pirmo teorētisko atoma modeli modeli ar diskrētiem enerģijas līmeņiem, kas spēja izskaidrot eksperimentāli novērotās ūdeņraža spektra līnijas. Sarežģītāku sistēmu aprakstam Bora atoma modelis nebija piemērojams. 20. gs. 20.–30. gados tika formulēta jauna teorija – kvantu mehānika –, kuras veidošanā ieguldījumu deva Verners Heizenbergs (Werner Karl Heisenberg), Ervins Šrēdingers (Erwin Rudolf Josef Alexander Schrödinger), Volfgangs Pauli (Wolfgang Ernst Pauli), Makss Borns (Max Born) un citi. Kvantu mehānika spēja izskaidrot spektru izcelsmi sarežģītos atomos, vienkāršās molekulās un cietvielās.
Spektroskopijas metodes izmanto praktisku visu dabaszinātņu un tehnoloģiju nozaru pētījumos. Tās ir ļoti jutīgas, atsevišķos gadījumos ļaujot molekulu un pat atsevišķu atomu detektēšanu un raksturošanu. Spektroskopiskiem mērījumiem raksturīga augsta izšķirtspēja, turklāt ir iespējams pētīt procesus ļoti īsos laika intervālos. Rezultātu un to interpretācijas verifikācijai vēlams izmantot ne tikai komplementāras eksperimentālās metodes, bet arī veikt spektru modelēšanu un skaitliskus aprēķinus. Nemitīgi tiek strādāts pie tehnoloģiskiem uzlabojumiem mērinstrumentu parametros, jaunu eksperimentālu un teorētisku metožu attīstīšanas, sarežģītu materiālu, struktūru un procesu analīzes, kā arī spektrometru minituriazācijas un plašākas pielietojamības veicināšanas.
Spektroskopijas metodes tiek izmantotas visās vadošajās dabas zinātņu nozaru pētniecības iestādēs. Pēc Scopus datubāzē pieejamās informācijas visvairāk ar spektroskopiju saistītus zinātniskus rakstus ir publicējuši pētnieki no Ķīnas Zinātņu akadēmijas (中国科学院), Francijas Nacionālā zinātnisko pētījumu centra (Centre national de la recherche scientifique) un Krievijas Zinātņu akadēmijas (Российская академия наук).
Pēc Scopus datubāzē pieejamās informācijas spektroskopijas pētījumi visbiežāk tiek publicēti: Journal of the American Chemical Society (kopš 1879. gada; izdevējs American Chemical Society), Applied Surface Science (kopš 1984. gada; izdevējs Elsevier), Applied Physics Letters (kopš 1962. gada; izdevējs American Institute of Physics), Electrochimica Acta (kopš 1959. gada; izdevējs Elsevier) un citi. Eksistē arī spektroskopijai veltīti periodiski izdevumi, tajā skaitā Progress in Nuclear Magnetic Resonance Spectroscopy (kopš 1965. gada; izdevējs Elsevier), Applied Spectroscopy (kopš 1970. gada; izdevējs SAGE), Spectrochimica Acta, Part B: Atomic Spectroscopy (kopš 1967. gada; izdevējs Elsevier) un citi.
Spektroskopijas attīstībā 20. gs. laikā ir bijuši vairāki nozīmīgi atklājumi, kas ir apbalvoti ar Nobela prēmiju. Gaismas neelastīgās izkliedes parādību pirmais eksperimentāli novēroja Čandrasekara Ramans (Sir Chandrasekhara Venkata Raman); šis atklājums bija priekšnosacījums Ramana spektroskopijas izveidei (Nobela prēmija fizikā 1930. gadā). Vilhelma Konrāda Rentgena (Wilhelm Conrad Röntgen) vārdā nosauktā jonizējošā starojuma veida atklāšana pavēra jaunas spektroskopisko eksperimentu iespējas (Nobela prēmijā fizikā 1901. gadā). Britu fiziķis Čārlzs Glovers Barkla (Charles Glover Barkla) pirmais novēroja ķīmiskiem elementiem raksturīgu rentgenstarojuma emisiju (Nobela prēmija fizikā 1917. gadā). Ar jaunu spektroskopisko metožu izveidi un attīstīšanu ir saistāmi vairāki Nobela prēmiju laureātu, tajā skaitā Manna Sīgbāna (Karl Manne Georg Siegbahn; Nobela prēmija fizikā 1924. gadā), Rūdolfa Mesbauera (Rudolf Ludwig Mössbauer; Nobela prēmija fizikā 1961. gadā) un Kaja Sīgbāna (Kai Manne Börje Siegbahn; Nobela prēmija fizikā 1981. gadā) vārdi. KMR spektroskopijai ir bagāta vēsture ar sasniegumiem: sākot ar pirmajiem Edvarda Pursela (Edward Mills Purcell) un Fēliksa Bloha (Felix Bloch) grupu KMR eksperimentiem kondensētā vidē (Nobela prēmija fizikā 1952. gadā), turpinot ar Kurta Vitriha (Kurt Wüthrich) devumu vairākdimensionālu KMR metožu pielāgošanai proteīnu pētījumos (Nobela prēmija ķīmijā 2002. gadā), līdz pat Pola Loterbēra Paul Christian Lauterbur) un Pītera Mensfīlda (Sir Peter Mansfield) risinājumiem KMR efekta izmantošanai attēlveidošanā (Nobela prēmija medicīnā 2003. gadā). Spektroskopijas metodēm un pielietojumiem progresējot, sagaidāms, ka augsto apbalvojumu saņems vēl daudzi zinātnieki.
Andris Antuzevičs "Spektroskopija". Nacionālā enciklopēdija. https://enciklopedija.lv/skirklis/-spektroskopija (skatīts 26.02.2026)